
【題目】碳及其化合物有廣泛的用途.
(1)反應C(s)+H2O(g)CO(g)+H2(g)△H=+131.3kJmol﹣1 , 達到平衡后,體積不變時,以下有利于提高H2產率的措施是 .
A.增加碳的用量
B.升高溫度
C.用CO吸收劑除去CO
D.加入催化劑
(2)已知,C(s)+CO2(g)2CO(g)△H=+172.5kJmol﹣1則反應 CO(g)+H2O(g)CO2(g)+H2(g)△H= .
(3)CO與H2一定條件下反應生成甲醇(CH3OH),可利用甲醇設計一個燃料電池,用KOH溶液作電解質溶液,多孔石墨做電極,該電池負極反應式為 .
(4)在一定溫度下,將CO(g)和H2O(g)各0.16mol分別通入到體積為2.0L的恒容密閉容器中,發生以下反應:CO(g)+H2O(g)CO2(g)+H2(g),得到如下數據:
t/min | 2 | 4 | 7 | 9 |
n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
①其它條件不變,降低溫度,達到新平衡前 v(逆)v(正)(填“>”、“<”或“=”).
②該溫度下,此反應的平衡常數K=;
③其它條件不變,再充入0.1mol CO和0.1mol H2O(g),平衡時CO的體積分數
(填“增大”、“減小”或“不變”).
【答案】
(1)BC
(2)﹣41.2kJ?mol﹣1
(3)CH3OH(g)+H2O﹣6e﹣=CO2+6H+
(4)<;![]() ;不變
;不變
【解析】解:(1)A.增加碳的用量,濃度不變,平衡不移動,故錯誤; B.升高溫度,平衡正向移動,H2產率增大,故正確;
C.用CO吸收劑除去CO,平衡正向移動,H2產率增大,故正確;
D.加入催化劑,平衡不移動,故錯誤;
故選:BC;(2)已知:①C(s)+H2O(g)CO(g)+H2(g),△H=+131.3kJmol﹣1 ,
②C(s)+CO2(g)2CO(g),△H=+172.5kJmol﹣1
根據蓋斯定律,①﹣②得:CO(g)+H2O(g)CO2(g)+H2(g),△H=131.3kJmol﹣1﹣172.5kJmol﹣1=﹣41.2kJmol﹣1 ,
所以答案是:﹣41.2kJmol﹣1;(3)甲醇是一種燃料,可利用甲醇設計一個燃料電池,用KOH溶液作電解質溶液,多孔石墨做電極,負極電極反應為:CH3OH6e﹣+8OH﹣═CO32﹣+6H2O
所以答案是:CH3OH(g)+H2O﹣6e﹣=CO2+6H+;(4)①正反應放熱,降溫時平衡正向移動,v(正)>v(逆),所以答案是:<;
②CO和H2O反應了0.06mol,則CO2和H2生成了0.06mol,平衡時各物質的濃度為:反應物CO和H2O為0.05mol/L,生成物CO2和H2為0.03mol/L,平衡常數表達式為K= ![]() =
= ![]() =
= ![]() ,所以答案是:
,所以答案是: ![]() ;
;
③反應前后氣體體積不變,與原平衡等比例加入反應物,平衡與原平衡等效,所以,平衡時各物質的濃度與原判斷相同,所以答案是:不變.
【考點精析】認真審題,首先需要了解化學平衡狀態本質及特征(化學平衡狀態的特征:“等”即 V正=V逆>0;“動”即是動態平衡,平衡時反應仍在進行;“定”即反應混合物中各組分百分含量不變;“變”即條件改變,平衡被打破,并在新的條件下建立新的化學平衡;與途徑無關,外界條件不變,可逆反應無論是從正反應開始,還是從逆反應開始,都可建立同一平衡狀態(等效)),還要掌握化學平衡的計算(反應物轉化率=轉化濃度÷起始濃度×100%=轉化物質的量÷起始物質的量×100%;產品的產率=實際生成產物的物質的量÷理論上可得到產物的物質的量×100%)的相關知識才是答題的關鍵.


 英才計劃期末調研系列答案
英才計劃期末調研系列答案科目:高中化學 來源: 題型:
【題目】密閉容器中加入4molA、1.2molC和一定量的B三種氣體,一定條件下發生反應,各物質的濃度隨時間變化如甲圖所示[已知t0~t1階段保持恒溫、恒容,且c(B)未畫出].乙圖為t2時刻后改變反應條件,反應速率隨時間的變化情況,已知在t2、t3、t4、t5時刻各改變一種不同的條件,其中t3時刻為使用催化劑. 
(1)若t1=15s,則t0~t1階段的反應速率為v(C)= .
(2)t4時刻改變的條件為 , .
(3)已知t0~t1階段該反應放出或吸收的熱量為Q kJ(Q 為正值),試寫出該反應的熱化學方程式: .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】除去括號內雜質所用試劑和方法,正確的是
A. 溴苯(液溴): KOH溶液分液B. 乙烯(SO2):酸性KMnO4溶液洗氣
C. 乙烷(乙烯): H2(催化劑)催化加氫D. 乙醇(水):分液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定條件下,在某密閉容器中進行如下反應:mA(g)+nB(g)pC(g)+qD(g),若增大壓強或升高溫度,重新達到平衡,反應速率隨時間的變化過程如圖所示,則對該反應的敘述正確的是( )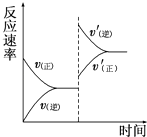
A.正反應是吸熱反應
B.逆反應是放熱反應
C.m+n<p+q
D.m+n>p+q
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化工廠生產的某產品只含C、H、O三種元素,其分子模型如圖所示(圖中球與球之間的連線代表化學鍵,如單鍵、雙鍵等). 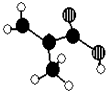
(1)該產品的結構簡式為;
(2)下列物質中,與該產品互為同分異構體的是(填序號),與該產品互為同系物的是(填序號).
①CH3CH=CHCOOH ②CH2=CHCOOCH3 ③CH3CH2CH=CHCOOH ④CH3CH(CH3)COOH
(3)在一定條件下,該產品跟乙二醇反應可得到分子式為C6H10O3的物質,該物質發生加聚反應可得到用來制作隱形眼鏡的高分子材料,這種高聚物的結構簡式為 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將5.10g鎂鋁合金加入120mL4.0molL﹣1的鹽酸中,待合金完全溶解后,得到溶液X.下列說法一定正確的是( )
A.合金完全溶解后產生的H2的物質的量為0.24mol
B.合金中的鎂與鋁的物質的量之比小于1
C.若向溶液X中加入270mL2.0molL﹣1NaOH溶液,充分反應,所得沉淀為Mg(OH)2
D.若向溶液X中加入足量的氨水,充分反應,所得沉淀經過過濾、洗滌后充分灼燒,則殘留固體質量大于8.50g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖為鐵制品循環利用的示意圖,根據圖示回答:
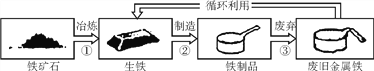
(1)從“①”“②”“③”中,選出一定發生化學變化的是____(填序號)。
(2)不能用鐵制容器盛放硫酸銅溶液的原因是_____________ (用化學方程式表示)。
(3)廢舊金屬“循環利用”的意義是____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】小明將未經砂紙打磨的鋁條放入盛有足量稀鹽酸的密閉容器中,用壓強傳感器測得容器內氣體壓強——反應時間的變化曲線如下圖所示。
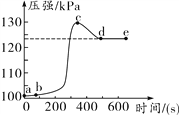
回答下列問題:
(1)ab段發生反應的化學方程式是______________。
(2)bc段發生反應的化學方程式是______________。
(3)cd段壓強變化的主要原因是__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向100 mL 0.25 mol·L-1的AlCl3溶液中加入金屬鈉完全反應,恰好生成只含NaCl和NaAlO2的澄清溶液,則加入金屬鈉的質量是( )
A.3.45 gB.2.3 gC.1.15 gD.0.575 g
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com