
【題目】某研究性學習小組設計了如圖裝置制取和驗證SO2的性質。
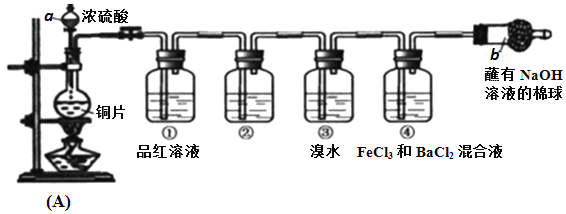
請回答:
(1)寫出A反應裝置中的化學方程式:____________
(2)棉球中NaOH溶液的作用是________________
(3)為了驗證SO2是酸性氧化物,洗氣瓶②中可選擇的試劑是_________。
A.澄清石灰水 B.無色酚酞試液 C.碘水 D.紫色石蕊試液
(4)下列說法正確的是____________。
A.先向裝置中加入試劑(藥品),再進行氣密性檢查
B.實驗開始時,只需打開分液漏斗的旋塞,即可使液體順利滴下
C.實驗開始后,洗氣瓶①和③中溶液均褪色,兩者均可證明SO2具有漂白性
D.實驗開始后,洗氣瓶④中可觀察到白色沉淀產生,該現象可說明SO2具有還原性
(5)寫出洗氣瓶③中反應的化學方程式:_____________
【答案】Cu+2H2SO4(濃)![]() CuSO4+SO2 ↑+2H2O 吸收尾氣,防止SO2污染大氣 AD D Br2 + SO2 + 2H2O=2HBr +H2SO4
CuSO4+SO2 ↑+2H2O 吸收尾氣,防止SO2污染大氣 AD D Br2 + SO2 + 2H2O=2HBr +H2SO4
【解析】
(1)A中銅與濃硫酸反應生成硫酸銅、二氧化硫、水;(2)二氧化硫有毒,能污染空氣,NaOH與二氧化硫反應生成亞硫酸鈉和水;(3)SO2是酸性氧化物,能與水反應生成亞硫酸,能與氫氧化鈣反應生成亞硫酸鈣沉淀和水;(4)A.氣體制備實驗,先進行氣密性檢查,再加入試劑(藥品); B.只需打開分液漏斗的旋塞,液體不能順利滴下;
C.SO2與溴水反應,體現SO2的還原性; D.Fe3+把SO2氧化為SO42-,所以洗氣瓶④中可觀察到白色沉淀產生;(5)SO2與溴水反應,生成硫酸和氫溴酸。
(1)A中銅與濃硫酸反應生成硫酸銅、二氧化硫、水,反應方程式是Cu+2H2SO4(濃)![]() CuSO4+SO2 ↑+2H2O;(2)NaOH與二氧化硫反應生成亞硫酸鈉和水,棉球中NaOH溶液的作用是吸收尾氣,防止SO2污染大氣;(3)SO2是酸性氧化物,能與水反應生成亞硫酸,能與氫氧化鈣反應生成亞硫酸鈣沉淀和水,為了驗證SO2是酸性氧化物,洗氣瓶②中可選擇的試劑是澄清石灰水或紫色石蕊試液,故選AD;(4)A.氣體制備實驗,先進行氣密性檢查,再加入試劑(藥品),故A錯誤; B.分液時,要先取下分液漏斗口部的玻璃塞,再打開旋塞,即可使液體順利滴下,故B錯誤; C.SO2與溴水反應,體現SO2的還原性,故C錯誤; D.因為二氧化硫通入氯化鋇溶液不能生成沉淀、Fe3+可以把SO2氧化為SO42-,所以洗氣瓶④中可觀察到有白色沉淀生成,該現象可說明SO2具有還原性,故D正確。(5)SO2與溴水反應,生成硫酸和氫溴酸,反應方程式是Br2 + SO2 + 2H2O=2HBr +H2SO4。
CuSO4+SO2 ↑+2H2O;(2)NaOH與二氧化硫反應生成亞硫酸鈉和水,棉球中NaOH溶液的作用是吸收尾氣,防止SO2污染大氣;(3)SO2是酸性氧化物,能與水反應生成亞硫酸,能與氫氧化鈣反應生成亞硫酸鈣沉淀和水,為了驗證SO2是酸性氧化物,洗氣瓶②中可選擇的試劑是澄清石灰水或紫色石蕊試液,故選AD;(4)A.氣體制備實驗,先進行氣密性檢查,再加入試劑(藥品),故A錯誤; B.分液時,要先取下分液漏斗口部的玻璃塞,再打開旋塞,即可使液體順利滴下,故B錯誤; C.SO2與溴水反應,體現SO2的還原性,故C錯誤; D.因為二氧化硫通入氯化鋇溶液不能生成沉淀、Fe3+可以把SO2氧化為SO42-,所以洗氣瓶④中可觀察到有白色沉淀生成,該現象可說明SO2具有還原性,故D正確。(5)SO2與溴水反應,生成硫酸和氫溴酸,反應方程式是Br2 + SO2 + 2H2O=2HBr +H2SO4。


 永乾教育寒假作業快樂假期延邊人民出版社系列答案
永乾教育寒假作業快樂假期延邊人民出版社系列答案科目:高中化學 來源: 題型:
【題目】某硫酸工廠的酸性廢水中砷(As)元素含量極高,為控制砷的排放,采用化學沉降法處理含砷廢水,工藝流程如下:
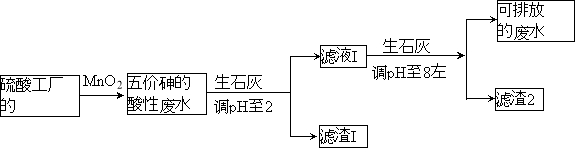
相關數據如下表,請回答以下問題:
表1.幾種鹽的Ksp
難溶物 | Ksp |
Ca3(AsO4)2 | 6.8×10-19 |
CaSO4 | 9.1×10-6 |
FeAsO4 | 5.7×10-21 |
表2.工廠污染物排放濃度及允許排放標準
污染物 | H2SO4 | As |
廢水濃度 | 29.4g/L | 1.6g·L-1 |
排放標準 | pH 6~9 | 0.5mg·L-1 |
(1)該硫酸工廠排放的廢水中硫酸的物質的量濃度c(H2SO4)= mol·L-1。
(2)若酸性廢水中Fe3+的濃度為1.0×10-4mol·L-1,c(AsO43-)= mol·L-1。
(3)工廠排放出的酸性廢水中的三價砷(H3AsO3弱酸)不易沉降,可投入MnO2先將其氧化成五價砷(H3AsO4弱酸),MnO2被還原為Mn2+,反應的離子方程式為 。
(4)在處理含砷廢水時采用分段式,先向廢水中投入生石灰調節pH到2,再投入生石灰將pH調節到8左右使五價砷以Ca3(AsO4)2形式沉降。
①將pH調節到2時廢水中有大量沉淀產生,沉淀主要成分的化學式為 ;
②Ca3(AsO4)2在pH調節到8左右才開始沉淀,原因為
。
③砷酸(H3AsO4)分步電離的平衡常數(25℃)為:K1=5.6×10-3 K2=1.7×10-7 K3=4.0×10-12,第三步電離的平衡常數的表達式為K3= 。Na3AsO4的第一步水解的離子方程式為:AsO43-+H2O![]() HAsO42-+OH-,該步水解的平衡常數(25℃)為: (保留兩位有效數字)。
HAsO42-+OH-,該步水解的平衡常數(25℃)為: (保留兩位有效數字)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某課外小組學生對Cl2與FeBr2溶液反應進行實驗探究。
操 作 | 現 象 |
取0.1 mol/L的FeBr2溶液10 mL,測溶液的pH | pH試紙變紅(約為4) |
| ⅰ.開始通入100 mL(折合標準狀況),溶液由淺綠色逐漸變黃; |
(1)用濃鹽酸和MnO2反應制取Cl2的化學方程式是 。
(2)pH≈4的原因是 (用化學用語表示)。
(3)現象i中溶液由淺綠色逐漸變黃。某學生猜測可能原因:①Cl2將Fe2+氧化為Fe3+,使溶液呈黃色;②Cl2將Br-氧化為Br2,使溶液呈黃色。證明原因①的實驗方案是 ;證明原因②的實驗方案是 。
(4)現象ⅱ中,溶液變為棕黃色。部分學生猜測①:可能是Cl2先將Fe2+氧化生成Fe3+,Cl2又繼續氧化Br-生成Br2。部分學生猜測②:可能是Cl2先將Fe2+氧化生成Fe3+,Fe3+將Br-氧化生成Br2。某學生設計實驗進行驗證,請完成下列表格:
由此實驗得出的結論是 。
試管 | 操作 | 現象 | 結論 |
a | 取2 mL FeCl2溶液,滴加少量氯水、2滴KSCN溶液,振蕩 |
| Cl2的氧化性強于Fe3+ |
b | 取2 mL FeCl3溶液,滴加少量溴化鈉溶液和少量CCl4,振蕩 | CCl4層沒有明顯變化 |
|
c | | CCl4層由無色變為橙黃色 | Cl2的氧化性強于Br2 |
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】金屬鎢用途廣泛,主要用于制造硬質或耐高溫的合金,以及燈泡的燈絲。高溫下,在密閉容器中用H2還原WO3可得到金屬鎢,其總反應為:
WO3(s) + 3H2(g)![]() W (s) + 3H2O (g)。請回答下列問題:
W (s) + 3H2O (g)。請回答下列問題:
(1)上述反應的化學平衡常數表達式為____________________。
(2) 某溫度下反應達平衡時,H2與水蒸氣的體積比為2:3,則H2的平衡轉化率為___________;隨溫度的升高,H2與水蒸氣的體積比減小,則該反應為 反應(填“吸熱”或“放熱”)。
(3)用H2還原WO2也可得到金屬鎢。已知:
WO2(s) + 2H2(g)![]() W (s) + 2H2O (g) ΔH =" +66.0" kJ·mol–1
W (s) + 2H2O (g) ΔH =" +66.0" kJ·mol–1
WO2(g) + 2H2(g)![]() W (s) + 2H2O (g) ΔH =-137.9 kJ·mol–1
W (s) + 2H2O (g) ΔH =-137.9 kJ·mol–1
則WO2(s)![]() WO2(g) 的ΔH = ______________________。
WO2(g) 的ΔH = ______________________。
(4)鎢絲燈管中的W在使用過程中緩慢揮發,使燈絲變細,加入I2可延長燈管的使用壽命,其工作原理為:W (s) +2I2(g)![]() WI4(g)。下列說法正確的有________(填序號)。
WI4(g)。下列說法正確的有________(填序號)。
a.燈管內的I2可循環使用 b.WI4在燈絲上分解,產生的W又沉積在燈絲上
c.WI4在燈管壁上分解,使燈管的壽命延長
d.溫度升高時,WI4的分解速率加快,W和I2的化合速率減慢
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以煤為原料,經過化學加工使煤轉化為氣體、液體、固體燃料以及各種化工產品的工業叫煤化工。
(1)將水蒸氣通過紅熱的炭即可產生水煤氣。反應為C(s)+H2O(g)CO(g)+H2(g) ΔH=+131.3 kJ·mol-1。
①該反應在常溫下_______(填“能”或“不能”)自發進行。
②一定溫度下,在一個容積可變的密閉容器中,發生上述反應,下列能判斷該反應達到化學平衡狀態的是____(填字母,下同)。
a.容器中的壓強不變
b.1 mol H—H鍵斷裂的同時,斷裂2 mol H—O鍵
c.c(CO)=c(H2)
d.密閉容器的容積不再改變
(2)將不同量的CO(g)和H2O(g)分別通入體積為2 L的恒容密閉容器中,進行反應CO(g)+H2O(g)CO2(g)+H2(g),得到如下三組數據:
實驗組 | 溫度/℃ | 起始量/mol | 平衡量/mol | 達到平衡所需時間/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 6 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①實驗1中從反應開始至平衡以CO2表示的平均反應速率為v(CO2)=________(取小數點后兩位,下同)。
②該反應的正反應為________(
(3)目前工業上有一種方法是用CO2來生產甲醇。一定條件下發生反應:CO2(g)+3H2(g)CH3OH(g)+H2O(g),如圖表示該反應進行過程中能量(單位為kJ·mol-1)的變化。在體積為1 L的恒容密閉容器中,充入1 mol CO2和3 mol H2,達到平衡后下列措施中能使c(CH3OH)增大的是________。

a.升高溫度
b.充入He(g),使體系壓強增大
c.將H2O(g)從體系中分離出來
d.再充入1 mol CO2和3 mol H2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】關于濃度均為0.1 mol/L的三種溶液:①氨水、②鹽酸、③氯化銨溶液,下列說法不正確的是
A. c(NH4+):③>①
B. 水電離出的c(H+):②>①
C. ①和②等體積混合后的溶液:c(H+)=c(OH-)+c(NH3·H2O)
D. ①和③等體積混合后的溶液:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某無色溶液X,由Na+、Mg2+、Ba2+、Al3+、AlO2-、MnO4-、CO32-、SO42-中的若干種離子組成,取溶液進行如下連續實驗:

(1)氣體A的成分是_______(填化學式,下同) ,氣體B的成分是_______。
(2)X溶液中一定存在的離子是______________。
(3)寫出步驟①中發生反應的所有離子方程式:______________。
(4)寫出步驟②中形成白色沉淀的離子方程式:______________。
(5)通過上述實驗,溶液X中不能確定是否存在的離子是______________;只要設計一個簡單的后續實驗就可以確定該離子是否存在,該方法是______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如下圖所示,室溫下的兩個連通剛性容器用活塞分開,左右兩室體積相同,左室充入一定量NO,右室充入一定量O2,且恰好使兩容器內氣體密度相同。打開活塞,使NO與O2充分反應且恢復至室溫,反應如下:2NO+O2=2NO2。不考慮NO2轉化為N2O4,下列判斷正確的是
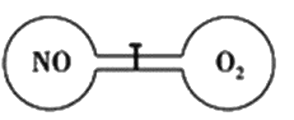
A. 反應前后左室的壓強相同
B. 反應后容器內的密度與反應前的相同
C. 開始時左右兩室中的分子數相同
D. 反應后容器內無O2存在
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,下列各組離子在指定溶液中能大量共存的是
A. 無色透明的溶液中:Fe3+、Mg2+、SCN–、Cl–
B.  =1×1012的溶液中:K+、Na +、CO32-、NO3-
=1×1012的溶液中:K+、Na +、CO32-、NO3-
C. c(Fe2+) =1mol·L1的溶液中:K+、NH4+、MnO4-、SO42-
D. 能使甲基橙變紅的溶液中:Na+、NH4+、SO42-、HCO3-
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com