
【題目】吲哚類化合物以其獨特的化學結構使其擁有重要的生理活性,在農藥、醫藥、化工、香料和染料等領域發揮著重要的作用。下圖是合成“氮-苯甲酰基-2-甲基-3吲哚乙酸甲酯”的路線

已知: 
![]() CH3CH=CHCOOH+CO2+H2O
CH3CH=CHCOOH+CO2+H2O
回答下列問題
(1)B的結構簡式為________,B分子中含有的官能團為________(填官能團名稱)。
(2)反應③為取代反應,該反應的化學方程式為________。
(3)C的名稱為________。
(4)A的結構簡式為________,反應⑤的反應類型為________。
(5)B有多種同分異構體,其中與B含有相同官能團的同分異構體有________種。
(6)已知
參照上述合成路線,以![]() 為原料(無機試劑任選),設計制備
為原料(無機試劑任選),設計制備![]() 的合成路線________。
的合成路線________。
【答案】 ![]() 碳碳雙鍵、羧基
碳碳雙鍵、羧基  甲醇
甲醇  取代反應 7 種
取代反應 7 種 
【解析】(1)根據已知信息,![]() 與
與![]() 反應生成B,B為
反應生成B,B為![]() ,其中含有的官能團有碳碳雙鍵、羧基,故答案為:
,其中含有的官能團有碳碳雙鍵、羧基,故答案為:![]() ;碳碳雙鍵、羧基;
;碳碳雙鍵、羧基;
(2)反應③為取代反應,反應的化學方程式為 ,故答案為:
,故答案為: ;
;
(3)根據![]() 和
和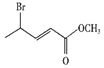 結構的差別,發生了酯化反應,因此C為甲醇,故答案為:甲醇;
結構的差別,發生了酯化反應,因此C為甲醇,故答案為:甲醇;
(4)根據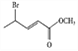 和
和 結構的差別,A為
結構的差別,A為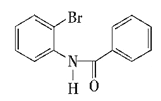 ,反應時除了生成
,反應時除了生成 ,還生成了溴化氫,屬于取代反應,故答案為:
,還生成了溴化氫,屬于取代反應,故答案為: ;取代反應;
;取代反應;
(5)B為![]() ,B有多種同分異構體,其中與B含有相同官能團的同分異構體有CH2=CHCH2CH2COOH、CH3CH=CHCH2COOH、CH2=C(CH3)CH2COOH、CH2=CHCH(CH3)COOH、CH3CH=C(CH3)COOH、CH3C(CH3)=CHCOOH、CH2=C(CH2CH3)COOH,共7種,故答案為:7;
,B有多種同分異構體,其中與B含有相同官能團的同分異構體有CH2=CHCH2CH2COOH、CH3CH=CHCH2COOH、CH2=C(CH3)CH2COOH、CH2=CHCH(CH3)COOH、CH3CH=C(CH3)COOH、CH3C(CH3)=CHCOOH、CH2=C(CH2CH3)COOH,共7種,故答案為:7;
(6)以![]() 為原料制備
為原料制備![]() ,可以用苯發生溴代反應生成溴苯,再發生硝化反應生成
,可以用苯發生溴代反應生成溴苯,再發生硝化反應生成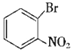 ,最后根據
,最后根據 ,將硝基還原即可,合成路線為
,將硝基還原即可,合成路線為![]() ,故答案為:
,故答案為:![]() 。
。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】為探究Na 與CO2反應產物,某化學興趣小組按下圖裝置進行實驗。
已知:CO + 2Ag ( NH3) 2OH=2Ag↓+( NH4 ) 2CO3 +2NH3

回答下列問題:
(1)寫出A 中反應的離子方程式__________________________。
(2)儀器X 的名稱是_____________,B 中的溶液為________________。
(3)先稱量硬質玻璃管的質量為m1 g ,將樣品裝入硬質玻璃管中,稱得樣品和硬質玻璃管的總質量是m2 g 。再進行下列實驗操作,其正確順序是________(填標號);
a.點燃酒精燈,加熱 b.熄滅酒精燈 c.關閉K1和K2
d.打開K1和K2,通入CO2至E 中出現渾濁
e.稱量硬質玻璃管 f.冷卻到室溫
重復上述操作步驟,直至硬質玻璃管恒重,稱得質量為m3 g 。
(4)加熱硬質玻璃管一段時間,觀察到以下現象
① 鈉塊表面變黑,熔融成金屬小球;
② 繼續加熱,鈉迅速燃燒,產生黃色火焰。反應完全后,管中有大量黑色物質;③ F 中試管內壁有銀白物質產生。
產生上述②現象的原因是____________________________________。
(5)探究固體產物中元素Na 的存在形式
假設一:只有Na2CO3;假設二:只有Na2O ;假設三:Na2O和Na2CO3均有
完成下列實驗設計,驗證上述假設:
步驟 | 操作 | 結論 |
1 | 將硬質玻璃管中的固體產物溶于水后過濾 | 假設一成立 |
2 | 往步驟1所得濾液中___________________________ | |
3 | _____________________________________________ |
(6)根據上述實驗現象及下表實驗數據,寫出Na 與CO2反應的總化學方程式___________。
m1 | m2 | m3 |
66.7g | 69.0g | 72.1g |
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏伽德羅常數的數值,下列說法正確的是( )
A. 12g石墨中含有C-C鍵的個數為1.5NA B. 60g SiO2中含有Si-O鍵的個數為2NA
C. 124 g P4中含P-P鍵的個數為4 NA D. 12 g金剛石中含C-C鍵的個數為NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某工廠對工業污泥中的Cr元素回收與再利用的工藝如下(已知硫酸浸取液中的金屬離子主要是Cr3+,其次是少量的Fe2+、Fe3+、Al3+、Ca2+、Mg2+):
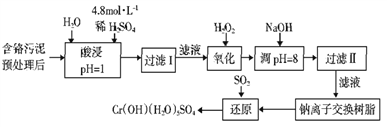
部分陽離子常溫下以氫氧化物形式沉淀時溶液的pH見下表:
陽離子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
開始沉淀時的pH | 1.9 | 7.0 | —— | —— | —— |
沉淀完全時的pH | 3.2 | 9.0 | 11.1 | 8 | 9(>9溶解) |
(1)實驗室用98%(密度為1.84g·cm-3)的濃硫酸配制200 mL 4.8 mol·L-1的硫酸溶液,配制時需要量取98%的濃硫酸的體積為_______ mL(保留小數點后一位小數),所用的玻璃儀器除燒杯、玻璃棒、量筒和酸式滴定管外,還需_______。
(2)過濾操作時,需要對沉淀進行洗滌,洗滌沉淀的方法是_______。
(3)加入H2O2的作用一方面是氧化+3價Cr使之轉變成+6價Cr(CrO42-或Cr2O72-),以便于與雜質離子分離:另一方面是_______。(離子方程式表示)
(4)調節溶液的pH=8除去的雜質離子是_______。
(5)鈉離子交換樹脂的原理為:Mn++nNaR→MRn+nNa+,被交換的雜質離子是_______。
(6)通SO2氣體時,還原過程發生以下反應(填寫缺項物質并配平):
____ Na2Cr2O7+ SO2+ = Cr(OH)(H2O)5SO4+ Na2SO4。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮及其化合物是科學家們一直在探究的問題,它們在工農業生產和生命活動中起著重要的作用。回答下列問題:
(一)已知① H2O(g)=H2O(1) △H=-44kJmol-1
②N2(g)+O2(g)![]() 2NO(g) △H=+180.5kJmol-1
2NO(g) △H=+180.5kJmol-1
③4NO(g)+6H2O(g)![]() 4NH3(g)+5O2(g) △H=+l025kJmol-1
4NH3(g)+5O2(g) △H=+l025kJmol-1
寫出NH3(g)和O2(g)在一定條件下轉化為N2(g)與液態水的熱化學方程式_________
(二)工業合成氨的原理為:N2(g)+3H2(g)![]() 2NH3(g) △H =-92.4kJmol-1。合成時反應溫度控制在500℃,壓強是2×l07~5×l07Pa,鐵觸媒做催化劑。
2NH3(g) △H =-92.4kJmol-1。合成時反應溫度控制在500℃,壓強是2×l07~5×l07Pa,鐵觸媒做催化劑。
(1)下列反應條件的控制不能用勒夏特列原理解釋的是_________。
A.及時分離出NH3
B.使用鐵觸媒做催化劑
C.反應溫度控制在500℃左右
D.反應時壓強控制在2×l07~5×l07Pa
(2)一定溫度下,將1molN2和3molH2置于一恒定容積的密閉容器中反應,一段時間后反應達到平衡狀態。下列說法中正確的是________。
A.單位時間內,有3mol H-H生成的同時又6md N-H斷裂,說明反應達到平衡狀態
B.N2和H2的物質的量之比保持不變時,說明反應達到平衡狀態
C.達到平衡狀態時,混合氣體的平均相對分子質量變大
D.達到平衡狀態后,再充入2molNH3,重新達到平衡后,N2的體積分數變小
(三)如圖表示H2的轉化率與起始投料比(n(N2)∶n(H2))、壓強的變化關系,則與曲線Ⅰ、Ⅱ、Ⅲ對應的壓強P1、P2、P3 從高到低的順序是_________________;測得B(X,60)點時N2的轉化率為50%,則X=________。
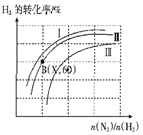
(四)一定溫度下,將lmolN2和3molH2置于一密閉容器中反應,測得平衡時容器的總壓為P,NH3的物質的量分數為20%,列式計算出此時的平衡常數Kp=________(用平衡分壓代替平衡濃度進行計算,分壓=總壓×體積分數,可不化簡)。
(五)以NO原料,通過電解的方法可以制備NH4NO3,其總反應是8NO+7H2O=3NH4NO3+2HNO3,寫出以惰性材料作電極的陽極反應式:_______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,二元弱酸H2R的pKa1=1.85,pKa2=7.45(已知pKa=﹣lgKa).在此溫度下向20mL0.1molL﹣1H2R溶液中滴加0.1molL﹣1的NaOH溶液,溶液的pH隨NaOH溶液體積的變化如圖所示.
下列有關說法正確的是( )
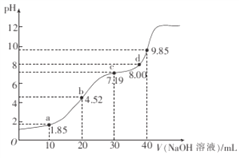
A. a點所示溶液中:c(H2R)+c(HR﹣)+c(R2﹣)=0.1molL﹣1
B. b點所示溶液中:c(Na+)>c(HR﹣)>c(H2R)>c(R2﹣)
C. c點所示溶液中:c(Na+)<3c(R2﹣)
D. d點所示溶液中:c(Na+)>c(R2﹣)>c(HR﹣)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據下列實驗現象所得出的結論錯誤的是
選項 | 實驗 | 現象 | 結論 |
A | 向KBrO3溶液中加入少量苯,然后通入少量Cl2 | 有機層呈橙色 | 氧化性:Cl2> KBrO3 |
B | 向KNO3和KOH混合溶液中加入鋁粉并加熱, 將濕潤的紅色石蕊試紙放在試管口 | 試紙變為藍色 | NO3-被還原為NH3 |
C | 向0.1 molL-1的Na2CO3溶液中加入兩滴酚酞,溶液顯淺紅色,微熱 | 紅色加深 | 鹽類水解是吸熱反應 |
D | 將0. 1 mol L-1的MgSO4溶液滴入到NaOH溶液中至不再有沉淀產生,再滴加0.1 molL-1的CuSO4溶液 | 白色沉淀逐漸變為藍色沉淀 | Ksp[Cu(OH)2]< Ksp[Mg(OH)2] |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列廣告語在科學性上正確的是( )
A. 本產品XX牌八寶粥由蓮子、淀粉、桂圓等精制而成,適合糖尿病患者,絕對不含糖
B. 請放心飲用農夫山泉系列飲品,該飲品絕對不含任何化學物質
C. 服用魚肝油(富含維生素D)有助于您的寶寶骨骼健康,有利于骨骼發育
D. 這種口服液含有豐富的N、P、Zn等微量元素
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二氧化碳被認為是加劇溫室效應的主要物質,資源化利用二氧化碳不僅可減少溫室氣體的排放,還可重新獲得燃料或重要工業產品。
Ⅰ.有科學家提出可利用FeO吸收和利用CO2,相關的熱化學方程式如下:
6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) , ΔH=-76.0 kJ·mol-1
②3FeO(s)+H2O(g)= Fe3O4(s)+H2(g) ΔH=-18.7 kJ·mol-1
(1)在上述反應中①中,每吸收1molCO2,就有_______molFeO被氧化。
(2)試寫出C(s)與水蒸氣反應生成CO2和H2的熱化學方程式___________。
Ⅱ.一定條件下,二氧化碳轉化為甲烷。向一容積為2L的恒容密閉容器中充人一定量的CO2和H2,在300℃時發生上述反應的反應CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g) 。達到平衡時,各物質的濃度分別為CO2 0.2mol·L-1、CH4 0.8mol·L-1、H2 0.8mol·L-1,H2O 1.6mol·L-1。
CH4(g)+2H2O(g) 。達到平衡時,各物質的濃度分別為CO2 0.2mol·L-1、CH4 0.8mol·L-1、H2 0.8mol·L-1,H2O 1.6mol·L-1。
(3)在300℃是,將各物質按下列起始濃度(mol·L-1)加入該反應容器中,達到平衡后,各組分濃度與上述題中描述的平衡濃度相同的是_____________。
選項 | CO | H2 | CH4 | H2O |
A | 0 | 0 | 1 | 2 |
B | 2 | 8 | 0 | 0 |
C | 1 | 4 | 1 | .2 |
D | 0.5 | 2 | 0.5 | 1 |
(4)若保持溫度不變,再向該容器內充入與起始量相等的CO2和H2,重新達到平衡時,CH4的濃
度________(填字母)。
A.c(CH4)=0.8mol·L-1 B.0.8mol L-1 >c(CH4) >1.6mol L-1
C.c(CH4)=l.6mol·L-1 D.C(CH4)>1.6mol L-1
(5)在300時,如果向該容器中加入CO20.8 mol·L-1、H21.0 mol·L-1、CH4 2.8 mol·L-1、H2O 2.0mol·L-1,則該可逆反應初始速率v正_____v逆 (填“>” 或“<”)。
(6)若已知200℃時該反應的平衡常數K=64.8 則該反應的△H_________0(填“>”或“<”)。
Ⅲ.某高校的研究人員研究出一種方法,可實現水泥生產時CO2零排放,其基本原理如圖所示

(7)上述電解反應在溫度小于900℃時進行,碳酸鈣先分解為CaO和CO2,電解質為熔融合碳酸鈣,陰極的電極反應式為3CO2+4e- =C+2CO32-,則陽極的電極反應式為______________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com