
【題目】乙醇被稱為21世紀的“綠色能源”。由于煤制乙酸工藝成熟、成本低廉,且乙酸相對乙醇有較大的價格差,因此開展乙酸加氫制乙醇的催化反應研究具有重要意義。回答下列問題:
(1)乙酸加氫制乙醇是一個復雜的反應體系,不同的反應條件會導致形成不同的產品分布,主要反應過程如下:
反應①CH3COOH(g) + H2(g)→CH3CHO(g) +H2O(g) H1
反應②CH3CHO(g) +H2(g) →CH3CH2OH(g) △H2
部分副反應如下:
反應③CH3CH2OH(g) + CH3COOH(g)→CH3COOCH2CH3(g) +H2O(g) H3
反應④CH3COOCH2CH3(g) +2H2(g) →2CH3CH2OH(g) H4
H4=___ (用H1、△H2、 H3表示)。
(2)乙酸加氫制乙醇的反應可表示為CH3COOH(g) + 2H2(g)==CH3CH2OH(g) + H2O(g) H<0,欲提高該反應中乙酸的平衡轉化率,可采取的兩條措施是_________。乙酸加氫生成乙酸乙酯( 副反應)的化學方程式可表示為____________.
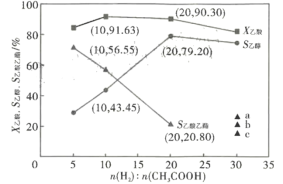
(3)在恒溫2609°C, 恒壓1.4MPa, 原料氣以一定的流速通過某催化劑發生乙酸加氫制乙醇等反應,氫/酸(物質的量)投料比對反應的影響如圖所示。X乙酸表示乙酸的轉化率, S乙醇、S乙酸乙酯分別表示乙醇、乙酸乙酯的選擇性,其中,S乙醇=![]() ,S乙酸乙酯=
,S乙酸乙酯=![]() 。根據圖象及數據分析,最佳氫/酸投料比值是_______________,該條件下,上述反應②____________(填“能”或“不能”)進行到底,理由是____________ ;根據圖中曲線變化規律,判斷氫/酸投料比=30時,S乙酸乙酯曲線最可能延伸至圖中a、b、c中的______點;氫/酸投料比=20時,計算H2的轉化率=_______. ( 列出計算式即可,下同),乙醇的分壓P乙醇=__________(分壓=總壓×物質的量分數)。
。根據圖象及數據分析,最佳氫/酸投料比值是_______________,該條件下,上述反應②____________(填“能”或“不能”)進行到底,理由是____________ ;根據圖中曲線變化規律,判斷氫/酸投料比=30時,S乙酸乙酯曲線最可能延伸至圖中a、b、c中的______點;氫/酸投料比=20時,計算H2的轉化率=_______. ( 列出計算式即可,下同),乙醇的分壓P乙醇=__________(分壓=總壓×物質的量分數)。
【答案】H1+H2-H3 降低溫度、增大壓強、增大氫氣的濃度、減小產物濃度 2CH3COOH(g) + 2H2(g) →CH3COOCH2CH3(g) +2H2O(g) 20 能 乙醇和乙酸乙酯的選擇性之和為100%,說明無乙醛生成,即反應②能進行到底 a 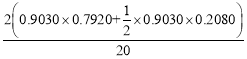 ×100%
×100% 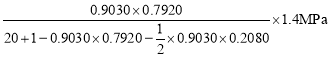
【解析】
(1)根據蓋斯定律,反應①+②-③得反應④,所以H4=H1+H2-H3;
(2)該反應H<0,為放熱反應,所以降低溫度可使平衡右移增大乙酸的轉化率;增加氫氣的用量也可以使平衡右移同時增大乙酸的轉化率;該反應為壓強減小的反應所以加壓可以使平衡右移增大乙酸的轉化率;及時移走生成物可以使平衡右移,增大乙酸的轉化率;綜上所述增大乙酸的轉化率可以:降低溫度、增大壓強、增大氫氣的濃度、減小產物濃度;乙酸可以氫氣反應生成乙醇,乙醇與乙酸反應可以生成乙酸乙酯,總的反應方程式為:2CH3COOH(g) + 2H2(g) →CH3COOCH2CH3(g) +2H2O(g);
(3)該反應的目的是制取乙醇,據圖可知當氫/酸投料比值是20時,乙酸的轉化率較高,同時乙醇的選擇性較大;
據圖可知各投料比情況下乙醇和乙酸乙酯的選擇性之和為100%,說明無乙醛生成,即反應②能進行到底;
投料比由20變為30時,S乙醇減小,而反應中生成物只有乙醇和乙酸乙酯,乙酸乙酯的選擇性下降,則乙酸乙酯的選擇性應上升,所以應延伸至a點;
投料比為20,則不妨設初始投料為:20mol氫氣、1mol乙酸,此時乙酸的轉化為90.30%,即反應乙酸0.9030mol,則生成的乙醇的物質的量為n乙醇=n乙酸×S乙醇=0.9030×0.7920mol,生成的乙酸乙酯的物質的量n乙酸乙酯=n乙酸×![]() S乙酸乙酯=
S乙酸乙酯=![]() ×0.9030×0.2080mol,根據發生的兩個反應:
×0.9030×0.2080mol,根據發生的兩個反應:
(主)CH3COOH(g) + 2H2(g)![]() CH3CH2OH(g) + H2O(g)
CH3CH2OH(g) + H2O(g)
(副)2CH3COOH(g) + 2H2(g) →CH3COOCH2CH3(g) +2H2O(g)
可知,消耗的氫氣的物質的量為2(n乙酸乙酯+n乙醇)=2(0.9030×0.7920mol+![]() ×0.9030×0.2080mol),則轉化率為
×0.9030×0.2080mol),則轉化率為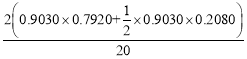 ×100%;
×100%;
以上兩個反應均為氣體物質的量減小的反應,由方程式可知n主=n乙醇=0.9030×0.7920mol,n副=n乙酸乙酯=![]() ×0.9030×0.2080mol,則反應后氣體總的物質的量為n總=(20+1-0.9030×0.7920-
×0.9030×0.2080mol,則反應后氣體總的物質的量為n總=(20+1-0.9030×0.7920-![]() ×0.9030×0.2080)mol,根據分壓=總壓×物質的量分數可知p乙醇=p總×
×0.9030×0.2080)mol,根據分壓=總壓×物質的量分數可知p乙醇=p總×![]() =
=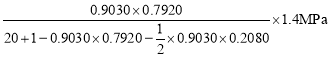 。
。


科目:高中化學 來源: 題型:
【題目】淀粉水解的產物(C6H12O6)用硝酸氧化可以制備草酸,裝置如圖1所示(加熱、攪拌和儀器固定裝置均已略去):實驗過程如下:

①將1:1的淀粉水乳液與少許硫酸(98%)加入燒杯中,水浴加熱至85℃~90℃,保持30min,然后逐漸將溫度降至60℃左右;
②將一定量的淀粉水解液加入三頸燒瓶中;
③控制反應液溫度在55~60℃條件下,邊攪拌邊緩慢滴加一定量含有適量催化劑的混酸(65%HNO3與98%H2SO4的質量比為2:1.5)溶液;
④反應3h左右,冷卻,減壓過濾后再重結晶得草酸晶體,硝酸氧化淀粉水解液過程中可發生下列反應:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2+8NO↑+10H2O
3H2C2O4+2HNO3→6CO2+2NO↑+4H2O
請回答下列問題:
(1)實驗①加入98%硫酸少許的作用是:_________;
(2)實驗中若混酸滴加過快,將導致草酸產量下降,其原因是_________;
(3)檢驗淀粉是否水解完全所用的試劑為_________;
(4)草酸重結晶的減壓過濾操作中,除燒杯、玻璃棒外,還必須使用屬于硅酸鹽材料的儀器有_________;
(5)將產品在恒溫箱內約90℃以下烘干至恒重,得到二水合草酸.用KMnO4標準溶液滴定,該反應的離子方程式為:2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O稱取該樣品0.12g,加適量水完全溶解,然后用0.020molL﹣1的酸性KMnO4溶液滴定至終點(雜質不參與反應),此時溶液顏色變化為_________,滴定前后滴定管中的液面讀數如圖2所示,則該草酸晶體樣品中二水合草酸的質量分數為_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據下述轉化關系,回答問題:

已知:①+CH3Br![]() CH3+HBr;
CH3+HBr;
②C物質苯環上一鹵代物只有兩種。
(1)寫出B物質的名稱__________;D物質的結構簡式________。
(2)寫出反應②的類型________;反應⑤的條件________。
(3)寫出反應⑥的化學方程式:________________________________。
(4)寫出D+E反應的化學方程式:_______________。
(5)反應②還有可能生成一種C16H18的有機物,其苯環上一鹵代物也只有兩種,寫出它的結構簡式:_______________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】C、O、Na、Cl、Fe、Cu是元素周期表前四周期中的常見元素。
(1)Fe在元素周期表中的位置是_____,Cu基態原子核外電子排布式為________。
(2)C和O的氣態氫化物中,較穩定的是________(寫化學式)。C的電負性比Cl的________(填“大”或“小”)。
(3)寫出Na2O2與CO2反應的化學方程式____________________________。
(4)碳有多種同素異形體,其中石墨烯與金剛石的晶體結構如圖所示:
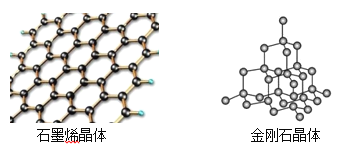
①在石墨烯晶體中,每個C原子連接___________個六元環,每個六元環占有___________個C原子。
②在金剛石晶體中,C原子所連接的最小環也為六元環,每個C原子連接__________個六元環,六元環中最多有_________個C原子在同一平面。
(5)刻蝕印刷電路的廢液中含有大量的CuCl2、FeCl2、FeCl3,任意排放將導致環境污染和資源的浪費,為了使FeCl3循環利用和回收CuCl2,回收過程如下:

①試劑X的化學式為______________;
②若常溫下1 L廢液中含CuCl2、FeCl2、FeCl3的物質的量濃度均為0.5 mol·L-1,則加入Cl2和物質X后,過濾。為使溶液鐵元素完全轉化為Fe(OH)3,而CuCl2 不產生沉淀。則應控制pH的范圍是____________________________(設溶液體積保持不變),已知:Ksp[Fe(OH)3]=1.0×10-38、Ksp[Cu(OH)2]=2.0×10-20、lg5=0.7。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關有機化合物的說法錯誤的是
A.葡萄糖和淀粉互為同系物
B.植物油含不飽和脂肪酸甘油酯,與氫氣加成后生成固態的人造脂肪
C.對三聯苯(![]() )分子中在同一直線上的原子最多有8個
)分子中在同一直線上的原子最多有8個
D.分子式為C7H16的烷烴,最長碳鏈上有5個碳原子的同分異構體共有5種(不含立體異構)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】無水MgBr2可用作催化劑,實驗室采用鎂屑與液溴為原料制備無水MgBr2,裝置如圖所示(夾持裝置省略)。
已知:①Mg和Br2劇烈反應,放出大量的熱; MgBr2 具有強吸水性;
②MgBr2 + 3C2H5OC2H5![]() MgBr2·3C2H5OC2H5。
MgBr2·3C2H5OC2H5。

實驗主要步驟如下:
步驟1:三頸燒瓶中裝人10 g鎂屑(鎂帶打磨光亮后剪碎)和
150 mL無水乙醚;儀器B中加入15 mL液溴,連接裝置;,
步驟2:打開止水夾,緩慢通人干燥的氮氣,直至溴完全導入三頸燒瓶中;
步驟3:反應完畢后恢復至室溫,過濾除去鎂,濾液轉移至另一干燥的燒瓶中,冷卻至0°C,析出.晶體,過濾得三乙醚合溴化鎂粗產品;
步驟4:用苯洗滌粗產品,減壓過濾,得三乙醚合溴化鎂,將其加熱至1609°C分解得無水MgBr2。
回答下列問題:
(1)MgBr2 的形成過程可用電子式表示為_____________
(2)儀器A的作用是_______;儀器B的名稱是___________.實驗前儀器A、B和三頸燒瓶內壁均需保持干燥,原因是__________________
(3)實驗中,______________(填“能”或“不能”)用干燥空氣代替干燥氮氣,理由是___________。
(4)若去除冰水浴,三頸燒瓶中生成MgBr2的同時,可能會生成少量雜質X, 1 mol X含50 mol e-,其化學式為______________________________________________。
(5)步驟4采用減壓過濾(降低容器內壓強,使固液快速分離),下列裝置可用作減壓過濾的是________________________(填序號)。

(6)為測定產品的純度(假定雜質不參與反應),可用EDTA (簡寫為Y4-,無色)標準溶液滴定,以絡黑T為指示劑(pH=6.3~11.6時顯藍色,pH>11.6時顯橙色)。已知: Mg2+與絡黑T形成的配合物(Mg2+_絡黑T)呈酒紅色,Mg2+與Y4-形成的MgY2-為無色;在pH約為9的緩沖溶液中滴定,反應的離子方程式可簡單表示為: Mg2+ + Y4-=MgY2-, Mg2+-絡黑 T+Y4- =MgY2- +絡黑T。
①判斷滴定終點的現象為__________________.
②測定前,先稱取0.2500g無水MgBr2產品,溶解后,加人2滴絡黑T試液作指示劑,用0. 0500 mol·L-1 EDTA標準溶液滴定至終點,重復三次滴定,平均消耗EDTA標準溶液26. 60 mL,則測得無水MgBr2產品的純度是___________________.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】從鋁土礦(主要成分為Al2O3,還有少量雜質)中提取鋁的工藝流程及步驟如下:
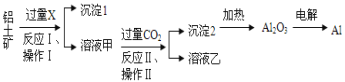
試回答下列問題:
(1)試劑X為__________;
(2)寫出試劑X溶解Al2O3的化學方程式________
(3)操作Ⅰ、操作Ⅱ均為_________(填操作名稱);
(4)金屬鋁與氧化鐵混合在高溫下,會發生劇烈的反應,該反應的化學方程式為_______;
(5)反應Ⅱ的離子方程式為______;
(6)電解熔融氧化鋁制取金屬鋁,若有0.6 mol電子發生轉移,理論上能得到金屬鋁的質量是________g。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2019年的化學諾貝爾獎頒給了為鋰電池研究作出貢獻的三位科學家。有兩種常見鋰電池:一種是采用鎳鈷錳酸鋰Li(NiCoMn)O2或鎳鈷鋁酸鋰為正極的“三元材料鋰電池”;另一種是采用磷酸鐵鋰為正極的磷酸鐵鋰電池。請回答下列問題:
(1)基態鈷原子的價電子排布式為____,Mn位于元素周期表的____ 區(填“s”或“p”或“d”或“ds”或“f”)。
(2)磷元素可以形成多種含氧酸H3PO4、H3PO2、H3PO3、HPO3,這四種酸中酸性最強的是___。PO43-的空間構型是 ___,中心原子的雜化方式是 ____。
(3)CoO、MnO兩種氧化物的熔點由高到低的順序是 ___,原因是 ___。
(4)PH3是____分子(填“極性”或“非極性”),其在水中的溶解性比NH3小,原因是 _____
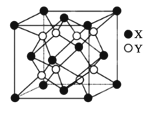
(5)硫化鋰Li2S(摩爾質量Mgmol-1)的納米晶體是開發先進鋰電池的關鍵材料,硫化鋰的晶體為反螢石結構,其晶胞結構如圖。若硫化鋰晶體的密度為ag.cm-3,則距離最近的兩個S2-的距離是___nm。(用含a、M、NA的計算式表示)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國自主研發的對二甲苯綠色合成項目取得新進展,其合成過程如圖所示。

下列說法不正確的是
A. 異戊二烯所有碳原子可能共平面
B. 可用溴水鑒別M和對二甲苯
C. 對二甲苯的一氯代物有2種
D. M的某種同分異構體含有苯環且能與鈉反應放出氫氣
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com