
【題目】NH3是一種重要的化工原料。
(1)不同溫度、壓強下.合破氦平衡休系NH3的物質的量分數如圖(N2和H2的起始物質的量之比為1:3)。
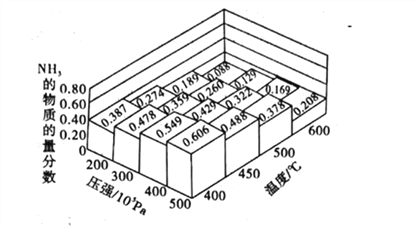
①分析圖中數據,升商溫度,該反應的平衡常數K值____(填“增大”“城小”或“不變”)。
②下列關于合成氨的說法正確是_____(填序號)。
A.工業上合成氨,為了提高氨的含量壓強越大越好
B.使用催化劑可以提高氨氣的產率
C.合成氨反應△H<0、△S<0,該反應高溫條件下一定能自發進行
D.減小n(N2):n(H2)的比值,有利于提高N2的轉化率
③如果開始時向密閉容器中投入1.0molN2和3.0molH2,則在500C、3×107Pa條件下達到平衡時N2的平衡轉化率=_______。(保留兩位有效數字)
(2)以氨氣代替氫氣研發氨燃料電池是當前科研的一一個熱點。氨燃料電池使用的電解質溶液是KOH溶液。該電池負極的電極反應式為_________________。
(3)NH3也是造成水體富營養化的重要因素之一,用次氯酸鈉水解生成的次氯酸將水中的NH3轉化為氮氣除去,其相關反應的熱化學方程式如下:
反應I:NH3 (aq)+HClO(aq)=NH2Cl(aq)+H2O(l) △H1=akJ/mol;
反應II:NH2Cl(aq)+HClO(aq)=NHCl(aq)v △H2=bkJ/mol;
反應III:2NHCl2(aq)+H2O(l)=N2(g)+HClO(aq)+3HCl(aq) △H3=ckJ/mol。
①2NH3(aq)+3HClO(aq)==N2(g)+ H2O(l) △H=________kJ/mol
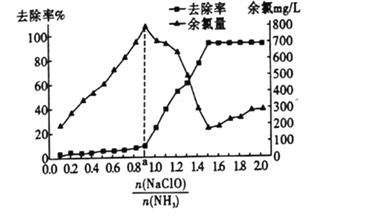
②已知在水溶液中NH2Cl較穩定,NHCl2不穩定易轉化為氮氣。在其他條件不變的情況下,改變![]() 對溶液中次氯酸鈉去氨氮效果與余氯(溶液中+1價氯元素的含量)的影響如圖l4所示。a點之前溶液中發生的主要反應為_______(填序號)。
對溶液中次氯酸鈉去氨氮效果與余氯(溶液中+1價氯元素的含量)的影響如圖l4所示。a點之前溶液中發生的主要反應為_______(填序號)。
A.反應I、I I B.反應I
③除氨氮過程中最佳的![]() 值約為______________。
值約為______________。
【答案】 減小 D 41% 2NH3 6e + 6OH=N2 + 6H2O ![]() B 1.5
B 1.5
【解析】(1)①由圖像可知,升高溫度,氨氣的物質的量分數減小,該反應為放熱反應;所以升高溫度,平衡左移,該反應的平衡常數K值減小;正確答案:減小。
②400℃、5×107Pa時氨氣的含量最大,則![]() 轉化率最高,但實際工業生產中壓強不能太大,因壓強太高,對生產設備要求也高,難以實現;A錯誤;催化劑不影響平衡移動,B錯誤;合成氨反應△H<0、△S<0,該反應在低溫條件下一定能自發進行,高溫不能,C錯誤;減小n(N2):n(H2)的比值,相等于增加氫氣的濃度,平衡右移,有利于提高N2的轉化率,D正確;正確選項D。
轉化率最高,但實際工業生產中壓強不能太大,因壓強太高,對生產設備要求也高,難以實現;A錯誤;催化劑不影響平衡移動,B錯誤;合成氨反應△H<0、△S<0,該反應在低溫條件下一定能自發進行,高溫不能,C錯誤;減小n(N2):n(H2)的比值,相等于增加氫氣的濃度,平衡右移,有利于提高N2的轉化率,D正確;正確選項D。
③通過圖像可知在500℃、3×107Pa條件下達到平衡時,氨氣的物質的量分數為26%,設氮氣的消耗量為xmol,根據反應方程式進行計算如下:
N2(g) + 3H2(g) ![]() 2NH3(g)
2NH3(g)
起始量 1 3 0
變化量 x 3x 2x
平衡量 1-x 3-3x 2x
根據氨氣的物質的量分數=2x/(1-x+3-3x+2x)×100%=26%,解之x=0.41mol,所以N2的平衡轉化率為41%;正確答案:41%。
(2)氨氣為堿性氣體,易與酸反應,所以電解質溶液應呈堿性,負極發生氧化反應,氨氣被氧化生產氮氣,電極反應式為2NH3 6e + 6OH=N2 + 6H2O;正確答案:2NH3 6e + 6OH=N2 + 6H2O。
(3)①根據化學方程式和蓋斯定律計算①×2 +②×2+③得到熱化學方程式為2NH3(aq)+3HClO(aq)==N2(g)+ H2O(l) △H= ![]() ;正確答案:
;正確答案:![]() 。
。
②用次氯酸鈉水解生成的次氯酸將水中的氨氮(用![]() 表示)轉化為氮氣除去,改變
表示)轉化為氮氣除去,改變 (即NaClO溶液的投入液),溶液中次氯酸鈉去除氨氮效果與余氯圖象變化中,次氯酸少氨氣多,a點前發生的反應是NH3(g)+HClO(aq)==NH2Cl(aq)+H2O(l);從圖象分析可以知道,反應中氨氮去除效果最佳為去除率較高同時余氯量最少,圖象中符合的比值為1.5;正確答案:B;1.5。
(即NaClO溶液的投入液),溶液中次氯酸鈉去除氨氮效果與余氯圖象變化中,次氯酸少氨氣多,a點前發生的反應是NH3(g)+HClO(aq)==NH2Cl(aq)+H2O(l);從圖象分析可以知道,反應中氨氮去除效果最佳為去除率較高同時余氯量最少,圖象中符合的比值為1.5;正確答案:B;1.5。


 百年學典課時學練測系列答案
百年學典課時學練測系列答案 仁愛英語同步練習冊系列答案
仁愛英語同步練習冊系列答案科目:高中化學 來源: 題型:
【題目】下列離子方程式表達正確的是
A. 用惰性電極電解氯化鎂溶液:2Cl-+2H2O![]() Cl2↑+H2↑+OH-
Cl2↑+H2↑+OH-
B. 碳酸氫鈉溶液與過量澄清石灰反應:HCO3-+Ca2++OH-= CaCO3↓+ H2O
C. NaHS04溶液中滴入Ba(OH)2溶液至S042-完全沉淀:2H++S042-+Ba2++ OH-= BaS04↓+2 H2O
D. 向明礬溶液中滴加過量氨水:Al3++4NH3![]() H2O=Al02-+4NH4++2H2O
H2O=Al02-+4NH4++2H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在微生物作用下電解有機廢水(含CH3COOH),可獲得淸潔能源H2。其原理如圖所示。下列有關說法不正確的是

A. 電源B極為負極
B. 通電后,若有0.1 mol H2生成,則轉移0. 2 mol電子
C. 通電后,H+通過質子交換膜向右移動,最終右側溶液pH減小
D. 與電源A極相連的惰性電極上發生的反應為CH3COOH-8e-+2H2O=2CO2↑+ 8H+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】恒溫下,在體積恒定的密閉容器中發生可逆反應:2SO2 (g)+ O2(g) ![]() 2SO3(g),下列不能用來判斷該反應達到平衡狀態的是
2SO3(g),下列不能用來判斷該反應達到平衡狀態的是
A. 容器中壓強不再變化 B. SO2的體積分數不再變化
C. 容器中混合物的密度不再變化 D. 容器中各物質的濃度不再變化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,下列各組離子在指定溶液中一定能大量共存的是
A. 使甲基橙呈紅色的溶液中:Na+、Ba2+、Cl-、NO3-
B. c( OH-) <![]() 的溶液中:Na+、Ca2+、ClO-、NO3-
的溶液中:Na+、Ca2+、ClO-、NO3-
C. 含有大量Fe( NO3)2 的溶液中:H+、NH4+、Cl-、SO42-
D. 水電離的c( H+)= 1× 10 -13mol/L的溶液中:K+、Mg2+、Br-、CH3COO-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)49 g H2SO4的物質的量是________;1.5 mol H2SO4的質量是_______,其中含有_______ mol H,含有_______g O。
(2)摩爾質量是指單位物質的量的物質所具有的質量。
①已知NH3的相對分子質量為17,則NH3的摩爾質量為________。
②NA為阿伏加德羅常數,已知a g某氣體中含分子數為b,則該氣體的摩爾質量為________。
③已知一個鐵原子的質量為b g,則鐵原子摩爾質量為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向Na2CO3、NaHCO3混合溶液中逐滴加入稀鹽酸,生成氣體的量隨鹽酸加入量的變化關系如圖所示,則下列離子組在對應的溶液中一定能大量共存的是(已知硝酸可將Fe2+氧化)( )
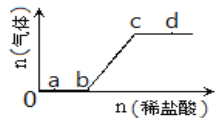
A. a點對應的溶液中:Na+、OH-、SO42-、NO3- B. b點對應的溶液中:K+、Ag+、MnO4-、NO3-
C. c點對應的溶液中:Fe2+、Ca2+、NO3-、Cl- D. d點對應的溶液中:K+、Fe2+、NO3-、SO42-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于分散系的敘述不正確的是
A. 分散系的分類:![]()
B. 用平行光照射FeCl3溶液和Fe(OH)3膠體,可以加以區分
C. 把FeCl3飽和溶液滴入到蒸餾水中,以制取Fe(OH)3膠體
D. 如圖所示是樹林中的晨曙,該反應與丁達爾效應有關
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】“高鐵出口”是中國的驕傲,高鐵產業的發展也給鋁工業帶來了春天。最近,某大學的超導回旋加速器實驗室發現了超重鋁42Al,關于42Al的說法錯誤的是
A.屬于金屬元素B.中子數與質子數之差為29
C.原子的核外電子數為13D.27Al和42Al是兩種不同的核素
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com