
【題目】中學化學中幾種常見物質的轉化關系如下圖所示:
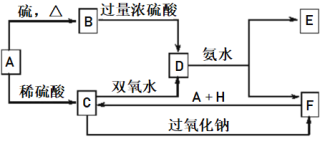
已知A是一種單質,將D溶液滴入沸水中可得到以F為分散質的紅褐色膠體。請回答下列問題:
(1)寫出C的溶液與雙氧水反應的離子方程式:_________________。
(2)寫出鑒定E中陽離子的實驗方法和現象:________________。
(3)F是一種難溶物質,其溶度積常數為1.0×10-39。向D溶液中加堿調節至pH為_______時,鐵離子剛好沉淀完全(離子濃度小于1.0×10-5 mol·L-1時,即可認為該離子沉淀完全)。
(4)已知1mol SO2(g)氧化為1mol SO3(g)的ΔH= –99 kJ·mol-1,單質硫的燃燒熱為296 kJ·mol-1,計算由S(s)生成3 molSO3(g)的△H=__________kJ·mol-1。
(5)在200 mL 1.5 mol·L-1 NaOH溶液中通入標準狀況下4.48L CO2氣體,完全反應后所得溶液中,各種離子濃度由大到小的順序是_____________。
【答案】2Fe2++ H2O2+2H+ = 2Fe3++ 2H2O 取少量E于試管中,加入過量氫氧化鈉溶液,加熱,在試管口放一濕潤的紅色石蕊試紙,觀察到紅色石蕊試紙變藍,證明E中有NH4+存在(或用蘸濃鹽酸的玻璃棒靠近,若有白煙也可) 2.7 -1185 c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
【解析】
將D溶液滴入沸水中可得到以F為分散質的紅褐色膠體,說明F為Fe(OH)3,D含有鐵離子,結合轉化關系,可知金屬單質A為Fe、B為FeS、C為FeSO4、D為Fe2(SO4)3、E為(NH4)2SO4,H為H2SO4。據此分析解答。
將D溶液滴入沸水中可得到以F為分散質的紅褐色膠體,說明F為Fe(OH)3,D含有鐵離子,結合轉化關系,可知金屬單質A為Fe、B為FeS、C為FeSO4、D為Fe2(SO4)3、E為(NH4)2SO4,H為H2SO4。
(1)FeSO4溶液與雙氧水反應生成硫酸鐵,反應的離子方程式為:2Fe2++H2O2+2H+═2Fe3++2H2O,故答案為:2Fe2++H2O2+2H+═2Fe3++2H2O;
(2)鑒定(NH4)2SO4中陽離子(NH4+)的實驗方法和現象為:取少量E于試管中,加入過量氫氧化鈉溶液,加熱,在試管口放一濕潤的紅色石蕊試紙,觀察到紅色石蕊試紙變藍,證明E中有NH4+存在,故答案為:取少量E于試管中,加入過量氫氧化鈉溶液,加熱,在試管口放一濕潤的紅色石蕊試紙,觀察到紅色石蕊試紙變藍,證明E中有NH4+存在;
(3)Fe(OH)3溶度積常數為1.0×10-39。要使鐵離子剛好沉淀完全,則需要滿足c(Fe3+)c3(OH-)=1.0×10-39,即c(OH-)=![]() =
=![]() ×10-11mol/L≈0.5×10-11mol/L,此時pH=2.7,故答案為:2.7;
×10-11mol/L≈0.5×10-11mol/L,此時pH=2.7,故答案為:2.7;
(4)①1mol SO2(g)氧化為1mol SO3(g) ΔH= –99 kJ·mol-1,即SO2(g)+![]() O2(g)=SO3(g) △H2=-99kJmol-1;②單質硫的燃燒熱為296 kJ·mol-1,則S(s)+O2(g)=SO2(g) △H1=-296kJmol-1,根據蓋斯定律將②×3+①×3可得3S(s)+
O2(g)=SO3(g) △H2=-99kJmol-1;②單質硫的燃燒熱為296 kJ·mol-1,則S(s)+O2(g)=SO2(g) △H1=-296kJmol-1,根據蓋斯定律將②×3+①×3可得3S(s)+![]() O2(g)=3SO3(g) △H3=3×(△H1+△H2)=-1185kJmol-1,故答案為:-1185 ;
O2(g)=3SO3(g) △H3=3×(△H1+△H2)=-1185kJmol-1,故答案為:-1185 ;
(5)4.48LCO2通入到200mL1.5mol/LNaOH溶液中,二氧化碳的物質的量=![]() =0.2mol,氫氧化鈉的物質的量1.5mol/L×0.2L=0.3mol。當1<
=0.2mol,氫氧化鈉的物質的量1.5mol/L×0.2L=0.3mol。當1<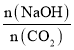 =1.5<2時,生成物是碳酸鈉和碳酸氫鈉,根據二氧化碳和氫氧化鈉物質的量之間的關系得方程式為2CO2+3NaOH=Na2CO3+NaHCO3+H2O,根據方程式知,碳酸鈉和碳酸氫鈉的物質的量相等,碳酸根離子和碳酸氫根離子水解而使溶液呈堿性,則c(OH-)>c(H+),碳酸根離子的水解能力大于碳酸氫根離子,所以c(HCO3-)>c(CO32-),鈉離子不水解,離子濃度最大,所以離子濃度大小順序是c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+
=1.5<2時,生成物是碳酸鈉和碳酸氫鈉,根據二氧化碳和氫氧化鈉物質的量之間的關系得方程式為2CO2+3NaOH=Na2CO3+NaHCO3+H2O,根據方程式知,碳酸鈉和碳酸氫鈉的物質的量相等,碳酸根離子和碳酸氫根離子水解而使溶液呈堿性,則c(OH-)>c(H+),碳酸根離子的水解能力大于碳酸氫根離子,所以c(HCO3-)>c(CO32-),鈉離子不水解,離子濃度最大,所以離子濃度大小順序是c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+


科目:高中化學 來源: 題型:
【題目】A、B、C三種元素在周期表中的位置如下圖所示,已知A、B、C原子序數之和為37。下列關于A、B、C三種元素的說法正確的是
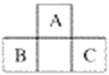
A. 元素B和C位于第四周期 B. 元素A的原子序數為7
C. 元素B最外層有5個電子 D. 元素C位于第三周期ⅤA族
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1) KClO3+ 6HCl (濃)=3Cl2 ↑+KCl +3H2O其中氧化劑為______;還原產物為_______;氧化產物與還原產物的質量比為_________; 濃鹽酸在反應中表現出來的性質是 ________ (填寫編號)
①只有還原性 ②還原性和酸性 ③只有氧化性 ④氧化性和酸性
(2)用雙線橋法標出以上反應的電子轉移的方向和數目___________
(3)Fe(OH)3膠體的制備:取一小燒杯,加入25 mL蒸餾水,加熱至沸騰,然后向沸水中逐滴加入5 ~ 6滴___________,繼續煮沸至體系呈______________,停止加熱,即制得Fe(OH)3膠體。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有關下列四個常用電化學裝置的敘述中,正確的是
|
|
|
|
圖Ⅰ 堿性鋅錳電池 | 圖Ⅱ 鉛蓄電池 | 圖Ⅲ 電解精煉銅 | 圖Ⅳ 銀鋅紐扣電池 |
A. 圖Ⅰ所示電池中,鋅為負極,MnO2的作用是催化劑
B. 圖II所示電池二氧化鉛為正極,放電過程中硫酸濃度不變
C. 圖III所示裝置工作過程中,電解質溶液中Cu2+濃度始終不變
D. 圖IV所示電池工作過程中,Ag2O是氧化劑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(NH4)2Cr2O7可用作有機合成催化劑、媒染劑、顯影液等。某化學興趣小組對(NH4 )2Cr2O7的部分性質及組成進行探究。已知:Cr2O72-(橙色)+ H2O 2CrO42-(黃色)+ 2H+。請回答下列問題:
(1)取少量(NH4)2Cr2O7濃溶液于試管中,滴加足量濃KOH溶液,振蕩、微熱,觀察到的主要現象是______________。
(2)為探究(NH4)2Cr2O7 (摩爾質量為252 g/mol)加熱的分解產物,按下圖連接好儀器,加熱裝置略去,在A中加入5.040 g樣品進行實驗。
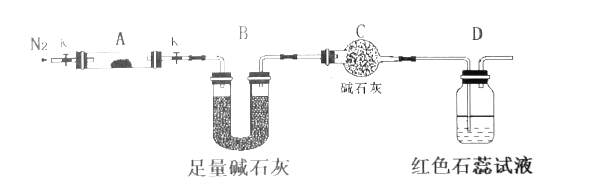
①儀器A的名稱是______________。
②連接好裝置,點燃酒精燈之前,先通入一段時間N2其目的為___________。
③反應結束后,依然要通一段時間的氮氣的原因是________________________。
④加熱A至恒重,觀察到D中溶液不變色,同時測得A中殘留物為Cr2O3、B中質量的變化為1.44 g,寫出重鉻酸銨加熱分解反應的化學方程式:____________________。
(3)實驗室常用甲醛法測定含(NH4)2Cr2O7的樣品中氮的質量分數(雜質不發生反應),其反應原理為 2Ba2++Cr2O72- + H2O = 2BaCrO 4↓+2H+、4NH4++6HCHO =3H++6H2O+(CH2)6N4H+ [滴定時,1 mo1 (CH2)6N4H+ 與 1 mo1 H+ 相當],然后用 NaOH 標準溶液滴定反應生成的酸。
實驗步驟:稱取樣品5.600 g,配成500 mL溶液,移取25.00 mL樣品溶液于 250 mL錐形瓶中,用氯化鋇溶液使Cr2O72-完全沉淀后,加入10 mL 20.00 mol·L-1的中性甲醛溶液,搖勻、靜置5 min后,加入12滴酚酞試液,用0.200 mo1 L-1 NaOH 標準溶液滴定至終點。重復上述操作3次,最終滴定用去NaOH標準溶液體積的平均值為16.00 mL。
①若滴定終點時,俯視讀數,則測定結果_____(填“偏大” “偏小”或“無影響”)。
②滴定計算得該樣品中氮的質量分數為___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述正確的是( )
A. Fe與S混合加熱生成FeS2
B. NaHCO3的熱穩定性大于Na2CO3
C. 過量的銅與濃硝酸反應有一氧化氮生成
D. 白磷在空氣中加熱到一定溫度能轉化為紅磷
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】請按要求回答下列問題:
(1)醇的官能團的名稱是_____。
(2)某氣態有機物相對于氫氣的密度為14,則其結構簡式為_____。
(3)某有機物的結構簡式如圖所示,則其一氯代物共有_____種。

(4)新戊烷用系統命名法命名應為_____。
(5)分別將等物質的量的C3H8、C4H8完全燃燒,消耗氧氣質量多的是_____(填分子式)。
(6)下列最簡式中,只能代表一種有機物的有_____(選填對應的序號)。
①CH3 ②CH2 ③CH2O ④CH4O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,反應A2(g)+B2(g)![]() 2AB(g)達到平衡的標志是( )
2AB(g)達到平衡的標志是( )
A.單位時間內生成nmolA2同時生成nmolAB
B.容器內的總壓強不隨時間的變化而變化
C.單位時間內生成2nmolAB同時生成nmolB2
D.單位時間內生成nmolA2同時生成nmolB2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D四種短周期元素,原子序數D>A>B>C,且A、B同周期,C、D同主族,A的原子結構示意圖如圖,B元素最外層電子數是次外層電子數的四分之一,C元素的氣態氫化物的水溶液顯堿性,據此填空:

(1)A元素氣態氫化物的電子式___,A、B、C、D四種元素按原子半徑由大到小的順序排列為___。(填元素符號)
(2)A的最高價氧化物與氫氧化鈉反應的離子方程式為___。
(3)A,C,D的最高價氧化物對應水化物的酸性強弱_______,C的氫化物比D的氫化物沸點___(填“高”或“低”),原因是___。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com