
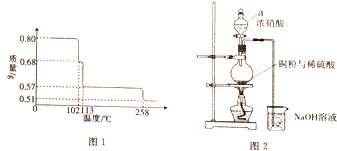
 硫酸在古代被稱為“綠礬油”,唐代煉丹家孤剛子在其所著《黃帝九鼎神丹經訣》中記有“煉石膽取精華法”即通過鍛燒膽礬而獲得硫酸的方法.請回答下列問題:
硫酸在古代被稱為“綠礬油”,唐代煉丹家孤剛子在其所著《黃帝九鼎神丹經訣》中記有“煉石膽取精華法”即通過鍛燒膽礬而獲得硫酸的方法.請回答下列問題:分析 (1)純凈物只含有一種物質,混合物是由兩種或者兩種以上物質組成;
(2)由圖分析可知,CuSO4•5H2O受熱到102℃時開始脫水分解,113℃時可得到較穩定的一種中間物,到258℃時才會繼續分解;在200℃時失去的水的質量為0.80g-0.57g=0.23g,根據相應的化學方程式即可確定此時固體物質的化學式;
取270℃所得樣品于一定溫度下灼燒生成CuO、SO2、S03 和O2,若產物中S03和S02的質量之比為5:4,則其物質的量之比為1:1,設生成1mol二氧化硫,依據氧化還原反應得失電子守恒結合原子個數守恒書寫方程式;
(3)①依據儀器形狀說出其名稱;依據分液漏斗使用方法可知:如果分液漏斗上口活塞小孔未與空氣相通,則液體不會流出;反應生成的一氧化氮、二氧化氮有毒,直接排放到空氣中會引起空氣污染,需要進行尾氣處理,二者能夠與氫氧化鈉反應生成亞硝酸鈉而被吸收;
②根據反應物判斷可能存在的雜質,溶解度不同的可溶性鹽可用重結晶法分離.
解答 解:(1)膽礬成分為CuSO4•5H2O,只含有一種物質屬于純凈物,故答案為:純凈物;
(2)CuSO4•5H2O受熱到102℃時開始脫水分解,113℃時可得到較穩定的一種中間物,到258℃時才會繼續分解.在200℃時失去的水的質量為0.80g-0.57g=0.23g,
根據反應的化學方程式:
CuSO4•5H2O$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4•(5-n)H2O+nH2O
250 18n
0.80g 0.80g-0.57g=0.23g
$\frac{250}{18n}$=$\frac{0.80}{0.23}$,解得n=4,
200℃時該固體物質的化學式為CuSO4•H2O;
取270℃所得樣品于一定溫度下灼燒生成CuO、SO2、S03 和O2,若產物中S03和S02的質量之比為5:4,則其物質的量之比為1:1,設生成1mol氧氣,依據氧化還原反應得失電子守恒
則生成二氧化硫的物質的量為2mol,依據產物中S03和S02的質量之比為5:4,則其物質的量之比為1:1,生成三氧化硫為2mol,依據硫原子個數守恒硫酸銅物質的量為4mol,氧化銅物質的量為4mol,方程式:4CuSO4$\frac{\underline{\;\;△\;\;}}{\;}$4CuO+2SO2↑+2SO3↑+O2↑;
故答案為CuSO4•H2O;4CuSO4$\frac{\underline{\;\;△\;\;}}{\;}$4CuO+2SO2↑+2SO3↑+O2↑;
(3)①依據儀器a形狀可知該儀器為:分液漏斗;依據分液漏斗使用方法可知:如果分液漏斗上口活塞小孔未與空氣相通,則液體不會流出;反應生成的一氧化氮、二氧化氮有毒,直接排放到空氣中會引起空氣污染,需要進行尾氣處理,二者能夠與氫氧化鈉反應生成亞硝酸鈉而被吸收,所以氫氧化鈉作用為:吸收尾氣,防止污染空氣;
故答案為:分液漏斗;上口的玻璃塞未打開(或凹槽未對準漏斗上的小孔);吸收尾氣,防止污染空氣污染;
②如果銅粉、硫酸及硝酸都比較純凈,則若硝酸過量會有硝酸銅生成,所以混有硝酸銅雜質,化學式:Cu(NO3)2;需利用溶解度的不同,用重結晶的方法進行分離,
故答案為:Cu(NO3)2;重結晶.
點評 本題考查化學實驗,意在考查對化學實驗原理、實驗設計和實驗結論的運用能力,涉及物質成分的判斷,化學方程式的書寫,儀器使用方法等,題目綜合性較強,難度中等.


 鴻圖圖書寒假作業假期作業吉林大學出版社系列答案
鴻圖圖書寒假作業假期作業吉林大學出版社系列答案科目:高中化學 來源: 題型:實驗題
| 實驗編號 | 加入試劑 | 實驗現象 |
| Ⅰ | 2滴 0.1mol/L FeCl3 溶液 | ①白色沉淀轉化為紅褐色沉淀 |
| Ⅱ | 4mL2mol/LNH4Cl溶液 | ②白色沉淀溶解,得無色溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CH3CH2OH+CH3COOH $?_{△}^{濃硫酸}$CH3COOCH2CH3+H2O | |
| B. | CH3CH2OH$→_{170℃}^{濃硫酸}$CH2=CH2↑+H2O | |
| C. | 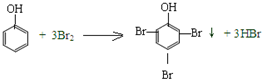 | |
| D. | CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 加入稀鹽酸產生無色氣體,將氣體通入澄清石灰水中,溶液變渾濁,一定有CO32- | |
| B. | 某物質做焰色反應時,火焰呈黃色,則該物質中肯定不存在鉀元素 | |
| C. | 加入氫氧化鈉溶液并加熱,產生的氣體能使濕潤紅色石蕊試紙變藍,一定有NH4+ | |
| D. | 加入氯化鋇溶液有白色沉淀產生,再加鹽酸,沉淀不消失,一定有SO42- |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 5.6 g鐵粉在0.1mol氯氣中充分燃燒,轉移電子數為0.3NA | |
| B. | 2.5mL 16mol•L-1濃硫酸與足量銅反應,轉移電子數為0.04NA | |
| C. | 7.8g Na2S和Na2O2的固體混合物中含有的陰離子數等于0.1NA | |
| D. | 常溫下,5.6 g 鐵釘與足量濃硝酸反應,轉移的電子數為0.3 NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鹽酸和氫氧化銅 | B. | 硫酸和氫氧化鈉溶液 | ||
| C. | 醋酸和氫氧化鋇溶液 | D. | 稀硝酸和氨水混合 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com