
【題目】下表是元素周期表的一部分,表中所列的字母分別代表一種化學元素。試回答下列問題:
a | |||||||||||||||||
b | c | d | e | f | |||||||||||||
g | h | i | j | k | l | m | |||||||||||
n | o | p |
(1)在周期表中,與元素b的化學性質最相似的鄰族元素是________(填寫以上表中字母對應的元素符號),該元素基態原子核外M層電子的自旋狀態________(填“相同”或“相反”)。
(2)元素As與________同族(填寫以上表中字母對應的元素符號),其簡單氣態氫化物的穩定性由大到小的順序是________。
(3)基態ρ原子成為陽離子時首先失去________軌道電子,基態![]() 的最外層電子排布式________。
的最外層電子排布式________。
(4)i的最高價氧化物對應的水化物與g的最高價氧化物對應的水化物反應的離子方程式為________________。
(5)下列關于上圖表中元素說法正確的是________(填序號)。
①未成對電子數最多的元素是O
②元素的電負性強弱;![]()
③元素的第一電離能:![]()
④簡單離子半徑:![]()
【答案】Mg 相反 N ![]() 4s
4s ![]()
![]() ①④
①④
【解析】
(1)根據對角線規則,Li與Mg互為對角線,Mg的基態原子核外M層電子排布是3s2。
(2)元素As與N同族,從上到下氣態氫化物穩定性減弱。
(3)鐵首先失去最外層電子,鐵離子的最外層即為第三層。
(4)氫氧化鋁與氫氧化鈉反應。
(5)①未成對電子數最多的元素是Cr,有6個未成對電子;②元素的電負性強弱; F > O > S;③元素的第一電離能: Si > Mg > Al;④簡單離子半徑:Cl-> O2-> Na+。
(1)根據對角線規則,與元素b的化學性質最相似的鄰族元素是Mg,該元素基態原子核外M層電子排布是3s2,自旋狀態相反;故答案為:Mg;相反。
(2)元素As與N同族,從上到下氣態氫化物穩定性減弱,因此其簡單氣態氫化物的穩定性由大到小的順序是![]() ;故答案為:N;
;故答案為:N;![]() 。
。
(3)鐵首先失去最外層電子,因此基態ρ原子成為陽離子時首先失去4s軌道電子,基態![]() 的最外層即為第三層,其電子排布式
的最外層即為第三層,其電子排布式![]() ;故答案為:4s;。
;故答案為:4s;。
(4)i的最高價氧化物對應的水化物氫氧化鋁與g的最高價氧化物對應的水化物氫氧化鈉,其反應的離子方程式為![]() ;故答案為:
;故答案為:![]() 。
。
(5)①未成對電子數最多的元素是Cr,有6個未成對電子,故正確;②元素的電負性強弱; F > O > S,故錯②誤;③元素的第一電離能: Si > Mg > Al,故③錯誤;④簡單離子半徑:Cl-> O2-> Na+,故④正確;綜上所述,答案為:①④。


 習題精選系列答案
習題精選系列答案科目:高中化學 來源: 題型:
【題目】室溫時幾種物質的溶解度見下表。室溫下,向500g硝酸鉀飽和溶液中投入2g食鹽,下列推斷正確的是( )
物質 | 溶解度( g/100g水) |
氯化鈉 | 36 |
硝酸鉀 | 32 |
硝酸鈉 | 87 |
氯化鉀 | 37 |
A.食鹽不溶解
B.食鹽溶解,無晶體析出
C.食鹽溶解,析出2 g硝酸鉀晶體
D.食鹽溶解,析出2 g氯化鉀晶體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知葡萄糖(C6H12O6)的燃燒熱是2804kJ·mol-1,當它在人體內氧化生成1g水時放出的熱量約為( )
A.26.0kJB.51.9kJC.155.8kJD.467.3kJ
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關鹽類水解的相關描述中,不正確的是( )
A.中國古代利用明礬溶液清除銅鏡表面的銅銹
B.![]() 溶液中:
溶液中:![]()
C.0.1 mol/L.醋酸鈉溶液20 mL與0.1 mol/L鹽酸10 mL混合后的溶液中:![]()
D.物質的量濃度相等的①![]() ;②
;②![]() ;③
;③![]() 三種溶液中,pH值由大到小的順序為②>③>①
三種溶液中,pH值由大到小的順序為②>③>①
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2019年12月20日,美國總統特朗普簽署了2020財政年度國防授權法案,對俄羅斯向歐洲進行天然氣輸出的“北溪2號”管道項目實施制裁,實施“美國優先發展戰略”。天然氣既是一種優質能源,又是一種重要化工原料,甲燒水蒸氣催化重整制備高純氫是目前的研究熱點。
(1)甲烷水蒸氣催化重整是制備高純氫的方法之一,已知在反應器中存在如下反應過程:
Ⅰ.![]()
Ⅱ.![]()
根據上述信息請寫出甲烷水蒸氣催化重整的熱化學反方程式:________________。
(2)在一定條件下向a、b兩個恒溫恒容的密閉容器中均通入![]() 和
和![]() ,利用反應Ⅰ制備
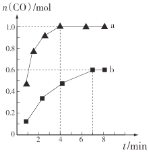
,利用反應Ⅰ制備![]() ,測得兩容器中CO的物質的量隨時間的變化曲線分別為a和b(已知容器a、b的體積為2 L)。
,測得兩容器中CO的物質的量隨時間的變化曲線分別為a和b(已知容器a、b的體積為2 L)。
則a、b兩容器的溫度________(填“相同”“不相同”或“不確定”);在達到平衡前,容器a的壓強________(填“逐漸增大”“不變”或“逐漸減小”);容器a中![]() 從反應開始到恰好平衡時的平均反應速率為________,在該溫度下反應的化學平衡常數K=________。
從反應開始到恰好平衡時的平均反應速率為________,在該溫度下反應的化學平衡常數K=________。
(3)某氫氧燃料電池以熔融態的碳酸鹽為電解質,其中![]() 參與電極反應。工作時負極的電極反應為
參與電極反應。工作時負極的電極反應為![]() 。如圖所示,根據相關信息回答下列問題:
。如圖所示,根據相關信息回答下列問題:
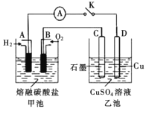
①正極的電極反應為________;
②當甲池中A電極理論上消耗![]() 的體積為448 mL(標準狀況)時,乙池中C、D兩電極質量變化量之差為________g。
的體積為448 mL(標準狀況)時,乙池中C、D兩電極質量變化量之差為________g。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鎂帶能在CO2中燃燒,生成氧化鎂和單質碳。
(1)碳元素形成的單質有金剛石、石墨、足球烯等。金剛石的熔點遠高于足球烯的原因是__________________________。24g金剛石中含有____個碳碳單鍵。
(2)氧化鎂的電子式為_______,CO2的結構式為________。與鎂同周期、離子半徑最小的元素,其原子最外層的電子排布式為________________,其中能量最高的電子有______個。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】新型納米材料MFe2Ox(3<x<4)中M表示+2價的金屬元素,在反應中化合價不變化.常溫下,MFe2Ox能使工業廢氣中的SO2轉化為S,轉化過程表示如圖.下列說法正確的是( )
![]()
A.x<yB.SO2是該反應的催化劑
C.MFe2Ox是還原劑D.氧化性:MFe2Oy>SO2
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com