
 如圖所示,隔板I固定不動,活塞Ⅱ可自由移動,M、N兩個容器中均發生反應:A(g)+3B(g)?2C(g)△H=-192kJ•mol-1.向M、N中,都通入x mol A和y mol B的混合氣體,初始M、N容積相同,保持溫度不變.下列說法正確的是( )
如圖所示,隔板I固定不動,活塞Ⅱ可自由移動,M、N兩個容器中均發生反應:A(g)+3B(g)?2C(g)△H=-192kJ•mol-1.向M、N中,都通入x mol A和y mol B的混合氣體,初始M、N容積相同,保持溫度不變.下列說法正確的是( )| A. | 平衡時A氣體在兩容器中體積分數可能相等 | |
| B. | 若x:y=1:2,則平衡時,M中的轉化率:A>B | |
| C. | 若x:y=1:3,當M中放出熱量172.8 kJ時,A的轉化率為90% | |
| D. | 若x=1,y=3,則達到平衡時反應物的轉化率N>M |
分析 M容器保持恒容,N容器保持恒壓,由于反應前后的氣體系數和不等,所以兩個平衡態也不一樣,
A、讓M、N中平衡時A的體積分數一樣,那么只能是M或N中,反應前后不論限度多少,A的體積分數始終為定值,假定反應的A為zmol,利用三段式表示平衡時各組分的物質的量據此判斷;
B、由于x:y=1:2,即y=2 x,設反應中消耗掉amolA,用a表示參加反應的B的物質的量,表示出轉化率,據此比較;
C、題目中熱化學方程式的意義為1molA完全反應,放熱192 kJ,根據實際放出的熱量計算參加反應的A的物質的量,進而表示出轉化率進行判斷;
D、N容器建立的平衡相當于恒溫恒容下建立的平衡減小容器體積,據此確定.
解答 解:M容器保持恒容,N容器保持恒壓,由于反應前后的氣體系數和不等,所以兩個平衡態也不一樣,
A、要讓M、N中平衡時A的體積分數一樣,那么只能是M或N中,反應前后不論限度多少,A的體積分數始終為定值,假定反應的A為zmol,則:
A(g)+3B(g)?2C(g)
起始:x y
反應:z 3z 2z
平衡:x-z y-3z 2z
故平衡時A的體積分數為$\frac{x-z}{x+y-2z}$,A的體積分數始終為定值,則x=y,即x=y時,平衡時A氣體在兩容器中體積分數相等,故A正確;
B、x:y=1:2,即y=2 x,設反應中消耗掉amolA,則:
A(g)+3B(g)?2C(g)
初始(mol):x 2x 0
變化(mol):a 3a 2a
故A的轉化率=$\frac{a}{x}$,B的轉化率=$\frac{3a}{2x}$,則平衡時,M中的轉化率:A<B,故B錯誤;
C、題目中熱化學方程式的意義:若1molA完全反應,放熱192 kJ,當M中放出熱量172.8 kJ時,參加反應的A的物質的量為$\frac{172.8kJ}{192kJ}$×1mol=0.9mol,故A的轉化率為$\frac{0.9}{x}$,故C錯誤;
D、x=1,y=3,由于反應后氣體體積減小,N容器建立的平衡相當于恒溫恒容下建立的平衡減小容器體積,壓強增大,平衡正向移動,達到平衡后的轉化率關系為:α(M)<α(N),故D正確.
故選AD.
點評 本題考查化學平衡的計算、平衡常數的計算等,難度較大,注意根據平衡常數判斷平衡移動方向.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題
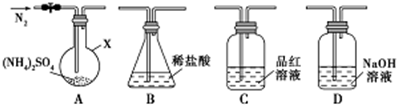
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 該條件下反應的平衡常數為1.6×103 | |
| B. | 通常情況下,該反應一定能自發進行 | |
| C. | 題給條件下,SO2的轉化率是80% | |
| D. | 當體系中SO2和SO3的速率之比是1:1時,則該反應達到化學平衡狀態 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
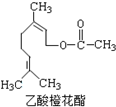 某食用香料乙酸橙花酯的結構簡式如圖所示,關于該有機物的下列敘述中正確的是( )
某食用香料乙酸橙花酯的結構簡式如圖所示,關于該有機物的下列敘述中正確的是( )| A. | ①②③ | B. | ①②④ | C. | ①②⑤ | D. | ①②③④ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 開發生物質能替代化石燃料 | B. | 向高空排放金屬冶煉產生的粉塵 | ||
| C. | 用催化轉化技術處理汽車尾氣 | D. | 大力推廣生產和使用無氟冰箱 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 碳酸鈉的水解反應:CO32-+H2O?HCO3-+OH- | |
| B. | 粗銅精煉時,與電源正極相連的是粗銅,電極反應式為:Cu-2e-═Cu2+ | |
| C. | 鋼鐵發生電化學腐蝕的負極反應式:Fe-2e-═Fe2+ | |
| D. | 堿性氫氧燃料電池負極反應式:O2+2H2O+4e-═4OH- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 氮可形成多種氣態氧化物,如NO、NO2、N2O4等.已知NO2和N2O4的結構式分別是
氮可形成多種氣態氧化物,如NO、NO2、N2O4等.已知NO2和N2O4的結構式分別是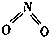 和
和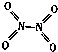 .實驗測得N-N鍵的鍵能為167kJ•mol-1,NO2中氮氧鍵的鍵能為 466kJ•mol-1,N2O4中氮氧鍵的鍵能為438.5kJ•mol-1.
.實驗測得N-N鍵的鍵能為167kJ•mol-1,NO2中氮氧鍵的鍵能為 466kJ•mol-1,N2O4中氮氧鍵的鍵能為438.5kJ•mol-1.| 時間/s | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 11:2 | B. | 9:4 | C. | 1:1 | D. | 5:1 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com