
【題目】乙烷和丙烷的混合氣體完全燃燒后,先將產物通過濃硫酸,濃硫酸增重30.6 g ,然后通過堿石灰,堿石灰增重52.8 g,混合氣體中乙烷和丙烷的體積比為( )
A.1∶1
B.2∶3
C.3∶2
D.3∶5
 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】COCl2(g)![]() CO(g)+Cl2(g) ΔH>0,當反應達到平衡時,下列措施:①升溫 ②恒容通入惰性氣體 ③增加CO濃度 ④減壓 ⑤加催化劑 ⑥恒壓通入惰性氣體,能提高COCl2轉化率的是
CO(g)+Cl2(g) ΔH>0,當反應達到平衡時,下列措施:①升溫 ②恒容通入惰性氣體 ③增加CO濃度 ④減壓 ⑤加催化劑 ⑥恒壓通入惰性氣體,能提高COCl2轉化率的是
A. ①④⑥B. ①②④C. ②③⑤D. ③⑤⑥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】當電解質中某離子的濃度越大時,其氧化性或還原性越強。利用這一性質,有人設計出如圖所示“濃差電池”(其電動勢取決于物質的濃度差,是由一種物質從高濃度向低濃度轉移而產生的)。實驗開始先斷開K1,閉合K2,發現電流計指針發生偏轉。下列說法錯誤的是
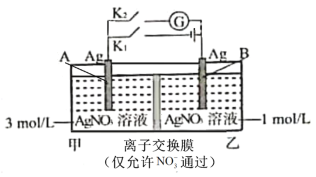
A.斷開K1、閉合K2,一段時間后電流計指針歸零,此時兩池Ag+濃度相等
B.斷開K1、閉合K2,當轉移0.1mol e-時,乙池溶液質量增加17.0 g
C.當電流計指針歸零后,斷開K2、閉合K1,一段時間后B電極的質量增加
D.當電流計指針歸零后,斷開K2、閉合K1,乙池溶液濃度增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)在101kPa時,H2在1mol O2中完全燃燒生成2mol液態水,放出571.6kJ的熱量,H2的燃燒熱為___,表示H2燃燒熱的熱化學方程式為___。
(2)①已知:CH4(g)+H2O(g)=CO(g)+3H2(g) △H= +206.2kJ·mol-1,CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=+247.4kJ·mol-1,則以甲烷為原料制取氫氣是工業上常用的制氫方法。CH4(g)與H2O(g)反應生成CO2(g)和H2(g)的熱化學方程式為:____。
②由氣態基態原子形成1mol化學鍵釋放的最低能量叫鍵能。已知表中所列鍵能數據,則N2(g)+3H2(g)![]() 2NH3(g) △H=__kJ·mol-1。
2NH3(g) △H=__kJ·mol-1。
化學鍵 | H-H | N-H | N≡N |
鍵能kJ·mol-1 | 436 | 391 | 945 |
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖,在左試管中先加入2 mL 95%的乙醇,并在搖動下緩緩加入3 mL濃硫酸,再加入2 mL乙酸,充分搖勻。在右試管中加入5 mL飽和Na2CO3溶液。按圖連接好裝置,用酒精燈對左試管小火加熱3~5 min后,改用大火加熱,當觀察到右試管中有明顯現象時停止實驗。
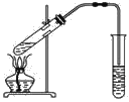
(1)寫出左試管中主要反應的化學方程式:_________________________________。
(2)加入濃硫酸的作用:_________________。
(3)反應開始時用酒精燈對左試管小火加熱的原因是____________________________(已知乙酸乙酯的沸點為77 ℃;乙醇的沸點為78.5 ℃;乙酸的沸點為117.9 ℃);后改用大火加熱的目的是______。
(4)分離右試管中所得乙酸乙酯和飽和Na2CO3溶液的操作為________(只填名稱),所需主要儀器為__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】水的電離平衡曲線如圖所示,下列說法正確的是
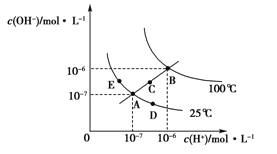
A. 圖中五點KW間的關系:B>C>A=D=E
B. 若從A點到D點,可采用在水中加入少量NaOH的方法
C. 若從A點到C點,可采用溫度不變時在水中加入適量H2SO4 的方法
D. 若處在B點時,將pH=2的硫酸與pH=12的KOH等體積混合后,溶液顯中性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖,在左試管中先加入2 mL 95%的乙醇,并在搖動下緩緩加入3 mL濃硫酸,再加入2 mL乙酸,充分搖勻。在右試管中加入5 mL飽和Na2CO3溶液。按圖連接好裝置,用酒精燈對左試管小火加熱3~5 min后,改用大火加熱,當觀察到右試管中有明顯現象時停止實驗。
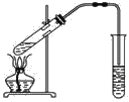
(1)寫出左試管中主要反應的化學方程式:_________________________________。
(2)加入濃硫酸的作用:_________________。
(3)反應開始時用酒精燈對左試管小火加熱的原因是____________________________(已知乙酸乙酯的沸點為77 ℃;乙醇的沸點為78.5 ℃;乙酸的沸點為117.9 ℃);后改用大火加熱的目的是______。
(4)分離右試管中所得乙酸乙酯和飽和Na2CO3溶液的操作為________(只填名稱),所需主要儀器為__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲醇是一種可再生能源,具有開發和應用的廣闊前景,工業上一般可采用如下方法來合成甲醇:
(1)用CO2生產甲醇。
已知:CO2(g)+3H2(g)═CH3OH(g)+H2O(l) △H=﹣akJmol﹣1;
2H2(g)+O2(g)═2H2O(l) △H=﹣b kJmol﹣1;
則表示CH3OH(g)燃燒的熱化學方程式為:____________________。
(2)用CO生產甲醇。
已知:CO(g)+2H2(g) ![]() CH3OH(g),下圖是該反應在不同溫度下CO的轉化率隨時間變化的曲線。
CH3OH(g),下圖是該反應在不同溫度下CO的轉化率隨時間變化的曲線。

①該反應的焓變ΔH__________0(填“>”、“<”或“=”)。
②T1和T2溫度下的平衡常數大小關系是K1_______K2 (填 “>”、“<”或“=”)。
③若容器容積不變,下列措施可增加甲醇產率的是______________。
A.升高溫度 B. 將CH3OH(g)從體系中分離
C.使用合適的催化劑 D. 充入He,使體系總壓強增大
(3)甲醇(CH3OH)可以用作燃料電池,該電池是采用鉑或碳化鎢作為電極催化劑,在稀硫酸電解液中直接加入純化后的甲醇,同時向一個電極通入空氣。負極發生的電極反應式是________________________,正極發生的電極反應式是_______________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com