用NA表示阿伏加德羅常數的值,下列說法中正確的是( )
A.6.2克白磷分子中含P-P鍵為0.6NA
B.10.0 mL18.0mol/L的濃硫酸中氫離子數為0.36 NA
C.6.4 g S6與S8的混合物中所含S原子數一定為0.2 NA
D.80 mL 10mol?L-1濃鹽酸與足量MnO2反應,轉移電子數為0.4NA
【答案】
分析:A.1mol白磷分子中含6molP-P鍵;
B.濃硫酸里,大部分的是以分子形式存在;
C.S
6與S
8都是單質,則硫原子的物質的量為
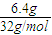
;
D.依據濃鹽酸隨著反應進行,濃度變稀后不再與二氧化錳反應進行解答.
解答:解:A.1mol白磷分子中含6molP-P鍵,6.2g白磷晶體物質的量=

=0.05mol,分子中含有的P-P鍵數約是0.3N
A,故A錯誤;
B.電解質在水中的電離靠水分子的作用,濃硫酸里只含有很少的水,硫酸大部分的是以分子形式存在,只有少部分電離,所以,10.0 mL18.0mol/L的濃硫酸中氫離子數遠小于0.36 N
A,故B錯誤;
C.S
2和S
8的混合物中只有S原子,則硫原子的物質的量為
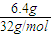
=0.2mol,則所含硫原子數一定為0.2N
A,故C正確;
D.80 mL 10mol?L
-1濃鹽酸含0.8molHCl,濃鹽酸與足量MnO
2混合加熱,隨著反應進行濃鹽酸濃度變稀后不再與二氧化錳進行反應,所以0.8mol HCl不能全部反應,故轉移電子數不是0.4N
A,故D錯誤;
故選C.
點評:本題考查阿伏伽德羅常數的計算,考查知識點全面,明確物質的構成、化學鍵的數目、反應的隱含條件等來解答,屬于易錯題,難度不大.

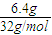 ;
; =0.05mol,分子中含有的P-P鍵數約是0.3NA,故A錯誤;
=0.05mol,分子中含有的P-P鍵數約是0.3NA,故A錯誤;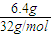 =0.2mol,則所含硫原子數一定為0.2NA,故C正確;
=0.2mol,則所含硫原子數一定為0.2NA,故C正確;

 世紀百通期末金卷系列答案
世紀百通期末金卷系列答案