
【題目】有機物 K 是某藥物的中間體,合成路線如圖所示:
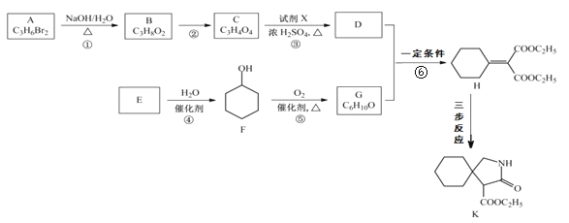
已知:i.R-CN![]() R-CH2-NH2
R-CH2-NH2
ii.R1-NH2+R2COOC2H5![]()
![]() +C2H5OH
+C2H5OH
回答下列問題
(1)A 的名稱是_______。
(2)反應①的化學方程式是_____。
(3)反應②的類型是_____。
(4)反應③中的試劑 X是_____。
(5)E 屬于烴,其結構簡式是_____。
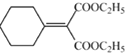
(6)H 中所含的官能團是_____。
(7)反應⑥的化學方程式是_____。
(8)H 經三步反應合成 K:H![]() I→J→K,寫出中間產物 I和J的結構簡式_____。
I→J→K,寫出中間產物 I和J的結構簡式_____。
【答案】1,3-二溴丙烷 Br-CH2-CH2-CH2-Br+2NaOH![]() HO-CH2-CH2-CH2-OH+2NaBr 氧化反應 C2H5OH
HO-CH2-CH2-CH2-OH+2NaBr 氧化反應 C2H5OH 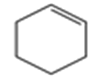 碳碳雙鍵、酯基
碳碳雙鍵、酯基 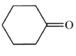 +C2H5OOC-CH2-COOC2H5
+C2H5OOC-CH2-COOC2H5![]()
 +H2O
+H2O 

【解析】
E屬于烴,E與水反應生成![]() ,則E為
,則E為![]() ;F發生催化氧化生成G為
;F發生催化氧化生成G為![]() ,由H的結構可知D為二元酯,C到D為酯化反應,可知C為二元酸、X為C2H5OH,故A為BrCH2CH2CH2Br、B為HOCH2CH2CH2OH、C為HOOCCH2COOH,則D為C2H5OOCCH2COOC2H5。
,由H的結構可知D為二元酯,C到D為酯化反應,可知C為二元酸、X為C2H5OH,故A為BrCH2CH2CH2Br、B為HOCH2CH2CH2OH、C為HOOCCH2COOH,則D為C2H5OOCCH2COOC2H5。
(1)根據分析可知A為BrCH2CH2CH2Br,A的名稱是:1,3-二溴丙烷;
(2)反應①為鹵代烴的取代反應,化學方程式是: ;
;
(3)反應②是羥基轉化為羧基,屬于氧化反應;
(4)由分析可知,反應③中的試劑X是:C2H5OH;
(5)E屬于烴,E與水反應生成![]() ,則E為
,則E為![]() ;
;
(6)由結構可知H中所含的官能團是:碳碳雙鍵、酯基;
(7)根據D的結構簡式和G的結構簡式可知反應⑥的化學方程式是: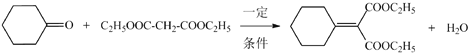 ;
;
(8)對比H與K的結構,H與HCN發生加成反應生成I為 ,然后還原生成J為
,然后還原生成J為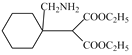 ,最后發生取代反應脫去1分子C2H5OH生成K。
,最后發生取代反應脫去1分子C2H5OH生成K。


 新非凡教輔沖刺100分系列答案
新非凡教輔沖刺100分系列答案科目:高中化學 來源: 題型:
【題目】高溫下,超氧化鉀晶體(KO2)呈立方體結構。如圖為超氧化鉀晶體的一個晶胞。則下列有關說法正確的是( )
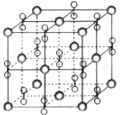
A. 晶體中與每個K+距離最近的O2-有6個
B. 超氧化鉀的化學式為KO2,每個晶胞含有1個K+和1個O2-
C. KO2中陰、陽離子個數比為1:2
D. 晶體中所有原子之間都以離子鍵結合
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】元素X的基態原子中的電子共有7個能級,且最外層電子數為1,X原子的內層軌道全部排滿電子,Y原子是最輕的原子,人們曾預言它可能是所有元素之母。
(1)X基態原子的電子排布式為___。
(2)C、H、O、N四種原子的電負性由大到小的順序為___。
(3)Y負離子基態電子排布式為___。
(4)下列變化:H-(g)=H(g)+e-吸收的能量為73kJ/mol,H(g)=H+(g)+e-吸收的能量為1311kJ/mol,則氫負離子的第一電離能為__。
(5)水溶液中有H3O+、H5O![]() 、H9O
、H9O![]() 等微粒的形式。H3O+中,中心原子的雜化類型是__,請畫出H5O
等微粒的形式。H3O+中,中心原子的雜化類型是__,請畫出H5O![]() 的結構式:__。
的結構式:__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2019年,我國科學家研發出一種新型的鋅碘單液流電池,已知M為陰離子交換膜,其原理如圖所示。下列說法不正確的是
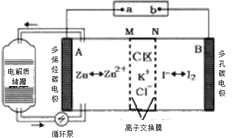
A.放電時A電極反應式為:Zn-2e﹣= Zn2+
B.充電時,B極與外接電源正極相連
C.放電時電解質儲罐中離子濃度增大
D.放電時當A極減少65g時,C區Cl﹣增加2NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是一氧化碳-空氣燃料電池的工作原理示意圖,a、b均為惰性電極。下列敘述中,正確的是( )
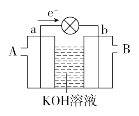
A. a電極發生還原反應,b電極發生氧化反應
B. a電極的電極反應式為CO+4OH-+2e-===CO32-+2H2O
C. A處通入的是空氣,B處通入的是CO
D. 用該電池作電源精煉銅,若陰極質量增加6.4 g,至少消耗標準狀況下的CO 2.24 L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.能源是國民經濟發展的重要基礎,我國目前使用的能源主要是化石燃料。
已知:C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
H2(g)+![]() O2(g)===H2O(g) ΔH2=-241.8 kJ·mol-1
O2(g)===H2O(g) ΔH2=-241.8 kJ·mol-1
CO(g)+![]() O2(g)===CO2(g) ΔH3=-283.0 kJ·mol-1
O2(g)===CO2(g) ΔH3=-283.0 kJ·mol-1
則煤氣化主要反應C(s)+H2O(g)=CO(g)+H2(g)的ΔH=____________________。
Ⅱ.為了減少CO的排放,某環境研究小組以CO和H2為原料合成清潔能源二甲醚(DME),反應如下:4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g) ΔH=-198 kJ·mol-1。
CH3OCH3(g)+H2O(g) ΔH=-198 kJ·mol-1。
(1)如圖所示能正確反映平衡常數K隨溫度變化關系的曲線為________(填曲線標記字母),其判斷理由是____________。

(2)在一定溫度下,向2.0 L固定容積的密閉容器中充入2 mol H2和1 mol CO,經過一段時間后,反應4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g)達到平衡。反應過程中測得的部分數據見下表:
CH3OCH3(g)+H2O(g)達到平衡。反應過程中測得的部分數據見下表:
時間/min | 0 | 20 | 40 | 80 | 100 |
n(H2)/mol | 2.0 | 1.4 | 0.85 | 0.4 | — |
n(CO)/mol | 1.0 | — | 0.425 | 0.2 | 0.2 |
n(CH3OCH3)/mol | 0 | 0.15 | — | — | 0.4 |
n(H2O)/mol | 0 | 0.15 | 0.2875 | 0.4 | 0.4 |
①0~20 min的平均反應速率v(CO)=__________________mol·L-1·min-1;
②達到平衡時,H2的轉化率為__________________;
③在上述溫度下,該反應的平衡常數K=______________________;
④能表明該反應達到平衡狀態的是________(填序號);
A CO的轉化率等于H2O的產率 B 混合氣體的平均相對分子質量不變
C v(CO)與v(H2)的比值不變 D 混合氣體的密度不變
⑤在上述溫度下,向平衡后的2 L容器中再充入0.4 mol H2和0.4 mol CH3OCH3(g),則化學平衡________移動(填“向左”“向右”或“不”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】
G是功能高分子材料。以甲苯為原料合成G的一種流程如下(部分條件和產物略去)。
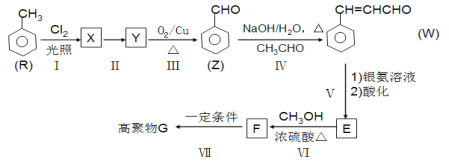
回答下列問題:
(1)W中官能團名稱是:_______________________;反應Ⅰ的類型是_________________。
(2)反應Ⅱ的試劑和條件是____________、_______________;Z的名稱是______________。
(3)寫出F→G的化學方程式:_________________。
(4)T是E的同分異構體,T的苯環上有3個互不相同的取代基,T的結構有______種。
(5)W分子中最多有______個原子共平面。
(6)以乙醇為原料,經過三步合成正丁醇。參照上述流程圖設計合成路線。___________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】![]() —NMR(核磁共振)、
—NMR(核磁共振)、![]() —NMR可用于測定蛋白質、核酸等生物大分子的空間結構,瑞士科學家庫爾特、維特里希等人為此獲得諾貝爾化學獎。下列有關
—NMR可用于測定蛋白質、核酸等生物大分子的空間結構,瑞士科學家庫爾特、維特里希等人為此獲得諾貝爾化學獎。下列有關![]() 、
、![]() 的敘述正確的是( )
的敘述正確的是( )
A. ![]() 與
與![]() 互為同位素B.
互為同位素B. ![]() 與C60互為同素異形體
與C60互為同素異形體
C. ![]() 、
、![]() 具有相同的中子數D.
具有相同的中子數D. ![]() 的核外電子數與中子數相同
的核外電子數與中子數相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】《環境科學》曾刊發我國科研部門采用零價鐵活化過硫酸鈉(Na2S2O7其中S為+6價)去除廢水中的正五價砷的研究成果,其反應機理模型如圖,(NA為阿伏加德羅常數的值)下列說法正確的是
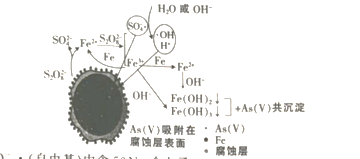
A.1 molSO4-· (自由基)中含50NA個電子
B.pH越大,越不利于去除廢水中的正五價砷
C.1 mol過硫酸鈉中含NA個過氧鍵
D.轉化過程中,若共有1 mol S2O82-被還原,則參加反應的Fe為56 g
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com