
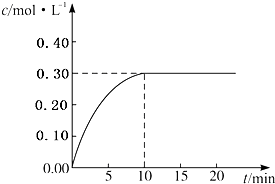
 目前工業上通常用生產水煤氣的方法獲得,反應的化學方程為:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0.若在某一容積為4L的密閉容器內,加入2.0mol的CO和3.0mol的H2O(g),在催化劑存在的條件下于850℃高溫加熱,發生上述反應,反應中CO2的濃度隨時間變化情況如圖所示:
目前工業上通常用生產水煤氣的方法獲得,反應的化學方程為:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0.若在某一容積為4L的密閉容器內,加入2.0mol的CO和3.0mol的H2O(g),在催化劑存在的條件下于850℃高溫加熱,發生上述反應,反應中CO2的濃度隨時間變化情況如圖所示:| 2 |
| 4 |
| 3 |
| 4 |
| c(CO2)?c(H2) |
| c(CO)?c(H2O) |
| 0.3×0.3 |
| 0.2×0.45 |
| 0.3 |
| 0.5 |
| 1×5 |
| 1×3 |
| 1×x |
| 1×3 |


科目:高中化學 來源: 題型:
| A、化學平衡常數與溫度無關 |
| B、兩種物質反應,不管怎樣書寫化學方程式,平衡常數不變 |
| C、化學平衡常數等于某時刻生成物濃度冪之積與反應物濃度冪之積的比值 |
| D、溫度一定,對于給定的化學反應,正逆反應的平衡常數互為倒數 |
查看答案和解析>>
科目:高中化學 來源: 題型:

查看答案和解析>>
科目:高中化學 來源: 題型:
 2SO2(g)+O2(g)?2SO3(g)反應過程的能量變化如圖所示.已知1mol SO2(g)氧化為1mol SO3(g)的△H=-99kJ?mol-1.請回答下列問題:
2SO2(g)+O2(g)?2SO3(g)反應過程的能量變化如圖所示.已知1mol SO2(g)氧化為1mol SO3(g)的△H=-99kJ?mol-1.請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:

查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
 鋁和氫氧化鉀都是重要的工業產品.請回答:
鋁和氫氧化鉀都是重要的工業產品.請回答:查看答案和解析>>
科目:高中化學 來源: 題型:
| A、HCO3-、NH4+、H+、Ca2+ |
| B、SO42-、H+、Cl-、NO3- |
| C、K+、Ag+、Na+、CO32- |
| D、Mg2+、OH-、SO32-、Cl-- |
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、⑥⑤②①④③ |
| B、⑥⑤①②③④ |
| C、④③②①⑤⑥ |
| D、④③①②⑥⑤ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com