
【題目】常溫下,下列關于電解質溶液中的比值問題說法正確的是
A.pH=11的NaOH和pH=3CH3COOH等體積混合:![]() <1
<1
B.向Ba(OH)2和氨水的混合液中加入鹽酸:![]() 增大
增大
C.向CaCO3和CaSO4的懸濁液中加入少量Na2CO3固體:![]() 增大
增大
D.向CH3COONa溶液中加水稀釋:![]() 減小
減小
科目:高中化學 來源: 題型:
【題目】常溫下,下列敘述正確的是( )
A.pH值等于5的HCl溶液和PH值等于9的NaOH溶液由水電離出的c(H+)之比為1:1
B.兩種醋酸溶液的物質的量濃度分別為c1和c2,pH分別為a和a+1,則c1=10c2
C.PH=2的HNO3溶液和PH=10的Ba(OH)2溶液等體積混合后的溶液的PH=7
D.向0.1 mol/L的氨水中加入少量醋酸銨固體,則溶液中c(OH-)/c(NH3·H2O)增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CO、CO2是化石燃料燃燒后的主要產物。
(1)將體積比為2:1的CO2和CO混合氣體通入有足量Na2O2固體的密閉容器中,同時不斷地用電火花點燃。將殘留固體溶于水,所得溶液中2c(CO32-)+c(HCO3-)____________c(Na+)(填“>”“<”或“=”) 。
(2)已知:2CO(g)+O2(g)=2CO2(g) △H=-566.0 kJ/mol;鍵能E(o=o)=499.0 kJ/mol
①CO(g)+O2(g)![]() CO2(g)+O(g) 的△H=____________kJ/mol
CO2(g)+O(g) 的△H=____________kJ/mol
②已知2500K時,①中反應的平衡常數為0.40。某時刻該反應體系中各物質濃度滿足: c(CO)·c(O2)=c(CO2)·c(O),則此時反應____________(填向左”或“向右”)進行。
(3)已知:反應CO2(g)![]() CO(g)+O(g)在密閉容器中CO2分解實驗的結果如下圖1;反應2CO2(g)
CO(g)+O(g)在密閉容器中CO2分解實驗的結果如下圖1;反應2CO2(g)![]() 2CO(g)+O2(g)中1molCO2在不同溫度下的平衡分解量如下圖2,
2CO(g)+O2(g)中1molCO2在不同溫度下的平衡分解量如下圖2, 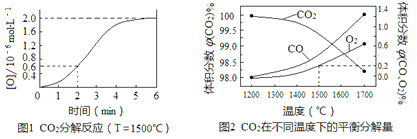
①分析圖1,求2min內v(CO2)=_______。
②分析圖2,1500℃時反應達平衡,此時容器體積為1 L,則反應的平衡常數K=______(計算結果保留1位小數)。
(4)為探究不同催化劑對CO和H2合成CH3OH的選擇性效果,某實驗室控制CO和H2的初始投料比為1:3進行實驗,得到如下數據:
選項 | T/K | 時間/min | 催化劑種類 | 甲醇的含量(%) |
A | 450 | 10 | CuO-ZnO | 78 |
B | 450 | 10 | CuO-ZnO-ZrO2 | 88 |
C | 450 | 10 | ZnO-ZrO2 | 46 |
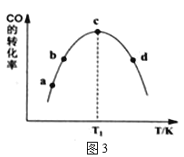
①由表1可知,該反應的最佳催化劑為____________(填編號);圖3中a、b、c、d四點是該溫度下CO的平衡轉化率的是____________。
②有利于提高CO轉化為CH3OH的平衡轉化率的措施有____________。
A. 使用催化劑CuO-ZnO-ZrO2 B. 適當降低反應溫度
C. 增大CO和H2的初始投料比 D. 恒容下,再充入a mol CO和3a mol H2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)25°C時,若向a mol·L-1的HA溶液中,滴加等體積的b mol·L-1的NaOH溶液,使溶液呈中性,用含a的代數式表示HA的電離平衡常數Ka=____________。
(2)25°C時,將a mol·L-1的氨水與0.01 mol·L-1的鹽酸等體積混合,反應完后溶液中c(NH4+)=c(Cl-),則溶液顯_____性(填“酸”、“堿”或“中”),用含a的代數式表示NH3·H2O的電離平衡常數Kb=____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NA表示阿伏加德羅常數,下列說法正確的是
A.含有25.2g HNO3的濃硝酸與足量的銅反應產生的NO2分子數目為0.1NA
B.1L0.6mol/L的Na2CO3溶液中含有的O原子數目為1.8NA
C.標準狀況下,22.4L的CH3COOH中含有的H原子個數為4NA
D.反應4NH3+6NO 5N2+6H2O中,當生成140g的N2時轉移12NA
5N2+6H2O中,當生成140g的N2時轉移12NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】回答下列關于N及其化合物的問題:
(1)配制Fe(NO3)2溶液時可否加入少量HNO3抑制Fe2+水解?_______,原因是__________________________________________。
(2)汽車尾氣中含有大量NO2,會導致環境污染,在汽車尾氣管裝上電化學轉化裝置在堿性水溶液環境中形成原電池,可部分解除NO2的污染,則該裝置的正極反應方程式為_________________________________;該裝置的負極原料為NH3,當電路中轉移8mole-時,負極消耗NH3的質量理論值約為________,(保留小數點后一位小數)實際上消耗NH3的量遠大于該理論值的原因可能為_________________________________________。
(3)NaOH溶液也可解除NO2的污染,該反應的化學方程式為_____________________________。
(4)第(3)問反應可產生致癌物質NaNO2,該物質中N元素的化合價為_____價,酸性環境中的NaNO2可用H2O2氧化處理,處理過程的離子方程式為___________________,若改用O2來氧化,則68g的H2O2相當于O2的質量為____;(保留小數點后一位小數)使用H2O2作為氧化劑的優點是________________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高聚物H是一種有機高分子材料,其合成路線如圖所示:
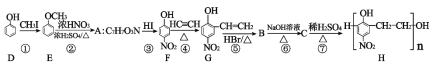
請回答下列問題:
(1)有機物D的名稱是__________________,A的結構簡式為_____________________;
(2)反應④的反應類型為________________;
(3)有機物F的核磁共振氫譜有____________組峰,峰面積之比為__________________;
(4)C到H的化學方程式為__________________________________________________;
(5)設計步驟①和步驟③的目的是_____________________________________________;
(6)滿足下列條件的比G多一個O原子的有機物的同分異構體,有_____________種。
①能夠發生銀鏡反應 ②含有硝基;
③能與FeCl3溶液發生顯色反應; ④苯環上有三個取代基;
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以鉛蓄電池為電源,石墨為電極電解CuSO4溶液(足量),裝置如下圖。若一段時間后Y電極上有6.4 g紅色物質析出,停止電解。下列說法正確的是( )
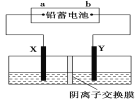
A.a為鉛蓄電池的負極
B.電解過程中SO42-向右側移動
C.電解結束時,左側溶液質量增重8 g
D.鉛蓄電池工作時正極電極反應式為:PbSO4+2e-===Pb+SO42-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫酸亞鐵銨晶體![]() 又稱摩爾鹽,
又稱摩爾鹽,![]() ,淺綠色能溶于水,在空氣中不易被氧化。實驗室以廢鐵屑(含少量硫化物、
,淺綠色能溶于水,在空氣中不易被氧化。實驗室以廢鐵屑(含少量硫化物、![]() 、油污等雜質)為料制備硫酸亞鐵銨晶體的流程如下:
、油污等雜質)為料制備硫酸亞鐵銨晶體的流程如下:
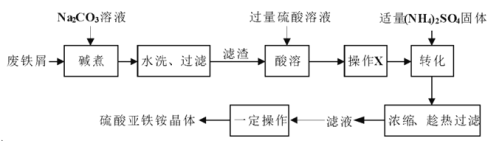
回答下列問題:
(1)“堿煮”的目的是___________。
(2)“酸溶”在如圖所示裝置中完成(部分裝置省略)。儀器![]() 的名稱是______,反應過程中有臭雞蛋氣味氣體產生,則裝置
的名稱是______,反應過程中有臭雞蛋氣味氣體產生,則裝置![]() 的作用是_____________________。
的作用是_____________________。
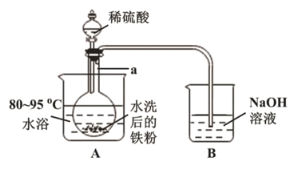
(3)欲檢測“酸溶”所得溶液中是否含有![]() ,可選用試劑為_____________,結果表明溶液中不含
,可選用試劑為_____________,結果表明溶液中不含![]() ,原因是______________________。“操作
,原因是______________________。“操作![]() ”是加入鐵粉,指出該操作的主要目的是________________。
”是加入鐵粉,指出該操作的主要目的是________________。
(4)產品純度測定:稱取![]() 硫酸亞鐵銨晶體樣品,加入硫酸溶解,用容量瓶配制成
硫酸亞鐵銨晶體樣品,加入硫酸溶解,用容量瓶配制成![]() 溶液。量取
溶液。量取![]() 所配溶液于錐形瓶中,消耗
所配溶液于錐形瓶中,消耗![]() 酸性
酸性![]() 標準溶液體積為
標準溶液體積為![]() 。
。
①滴定過程反應的離子方程式為_____________。
②產品的純度為_______________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com