
【題目】將2.56 g Cu和一定量的濃硝酸反應,隨著Cu的不斷減少,反應生成氣體的顏色逐漸變淺,當Cu反應完畢時,共收集到氣體1.12 L(標準狀況),則反應中消耗HNO3的物質的量為 ( )
A.0.13 molB.1 molC.1.05 molD.0.05 mol
【答案】A
【解析】
Cu與濃硝酸反應:Cu+4HNO3(濃)=Cu(NO3)2+2NO2↑+2H2O,隨著Cu的不斷減少,反應生成氣體的顏色逐漸變淺,發生3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,根據N元素守恒,消耗硝酸中N的原子轉化成硝酸銅中的N原子和氮的氧化物中N原子,據此分析;
Cu與濃硝酸反應:Cu+4HNO3(濃)=Cu(NO3)2+2NO2↑+2H2O,隨著Cu的不斷減少,反應生成氣體的顏色逐漸變淺,發生3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,消耗硝酸的物質的量為2n[Cu(NO3)2]+n(NO、NO2)=2×![]() +
+![]() =0.13mol,故A正確;
=0.13mol,故A正確;
答案:A。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】東晉![]() 華陽國志
華陽國志![]() 南中志
南中志![]() 卷四中已有關于白銅的記載,云南鎳白銅
卷四中已有關于白銅的記載,云南鎳白銅![]() 銅鎳合金
銅鎳合金![]() 聞名中外,曾主要用于造幣,亦可用于制作仿銀飾品
聞名中外,曾主要用于造幣,亦可用于制作仿銀飾品![]() 回答下列問題:
回答下列問題:
![]() 鎳元素基態原子的電子排布式為______,3d能級上的未成對電子數為______.
鎳元素基態原子的電子排布式為______,3d能級上的未成對電子數為______.
![]() 硫酸鎳溶于氨水形成
硫酸鎳溶于氨水形成![]() 藍色溶液.
藍色溶液.
![]() 中陰離子的立體構型是______.
中陰離子的立體構型是______.
![]() 在
在![]() 中
中![]() 與
與![]() 之間形成的化學鍵稱為___,提供孤電子對的成鍵原子是______.
之間形成的化學鍵稱為___,提供孤電子對的成鍵原子是______.
![]() 氨是______分子
氨是______分子![]() 填“極性”或“非極性”
填“極性”或“非極性”![]() ,中心原子的軌道雜化類型為______.
,中心原子的軌道雜化類型為______.
![]() 單質銅及鎳都是由______鍵形成的晶體;元素銅與鎳的第二電離能分別為:
單質銅及鎳都是由______鍵形成的晶體;元素銅與鎳的第二電離能分別為:![]() 、
、![]() 的原因是______.
的原因是______.
![]() 某鎳白銅合金的立方晶胞結構如圖所示.
某鎳白銅合金的立方晶胞結構如圖所示.
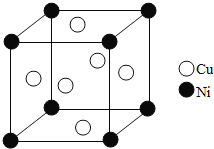
![]() 晶胞中銅原子與鎳原子的數量比為______.
晶胞中銅原子與鎳原子的數量比為______.
![]() 若合金的密度為
若合金的密度為![]() ,晶胞參數
,晶胞參數![]() ______nm.
______nm.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D、E為五種常見的有機物,它們之間的轉化關系如圖1所示。其中A是一種可以使溴水及酸性KMnO4溶液褪色的氣體,可作為水果的催熟劑。D分子的模型如圖2所示。
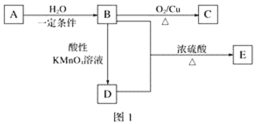

請回答下列問題:
(1)A的結構簡式為___________,D中的官能團為_________。(寫名稱)
(2)A生成B的反應類型為__________________________
(3)由B生成C的反應方程式為______________________反應類型是__________。
(4)B與D反應生成E的化學方程式為______________________反應類型是__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以下是一些元素的信息,其中有一種元素不在短周期。
元素A | 元素B | 元素C | 元素X | 元素Y |
單質是一種常見金屬,與元素X形成黑色和紅棕色三種常見化合物 | 基態原子M層p軌道上有5個電子 | 短周期中金屬性最強,與X反應能生成兩種常見化合物 | 最外層電子數是內層電子數的3倍,能形成雙原子陰離子 | 單質為雙原子分子,結構中σ鍵與π數目比為1:2 |
根據上述信息回答下列問題:
(1)寫出X3的等電子體_____(寫一個即可),基態Y原子核外電子所占據的最高能級的電子云形狀為______。
(2)A元素在元素周期表中的___區,基態A原子的未成對電子有___個。
(3)B、C、X的簡單離子半徑由大到小的順序為______(填離子符號)。
(4)HX與HY兩種共價鍵中,鍵的極性較強的是____,鍵長較長的是____(X、Y用元素符號表示)。
(5)Y與碳元素形成的一種陰離子與Y2是等電子體,請寫出該陰離子的電子式___。Y的常見氫化物易溶于水的主要原因是___。
(6)鉑絲蘸取化合物CB在酒精燈上灼燒,火焰呈___色,顯色原因是___(填序號)。
A.CB受熱揮發 B.CB受熱分解
C.C離子中電子躍遷 D.B離子中電子躍遷
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式書寫正確的是( )
A. 氫氧化鋇溶液中加入硫酸銨:Ba2++OH-+NH4++SO42-=BaSO4↓+NH3·H2O
B. 用惰性電極電解CuCl2溶液:Cu2++2Cl-+2H2O![]() Cu(OH)2↓+H2↑+Cl2↑
Cu(OH)2↓+H2↑+Cl2↑
C. 向漂白粉溶液中通入少量二氧化硫:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
D. 向苯酚鈉溶液中通入少量的CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】由于碳碳雙鍵(![]() )中的π鍵不能自由旋轉,因此
)中的π鍵不能自由旋轉,因此 ![]() 和
和 是兩種不同的化合物,互為順反異構體。則分子式為C3H4Cl2的化合物的烯類異構體有
是兩種不同的化合物,互為順反異構體。則分子式為C3H4Cl2的化合物的烯類異構體有
A. 5種B. 6種C. 7種D. 8種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】關于下圖所示原電池裝置的說法錯誤的是( )
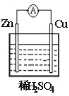
A.Zn為負極,反應為Zn-2e-=Zn2+B.銅棒上發生還原反應
C.電子從鋅片經導線流向銅片D.溶液中氫離子濃度保持不變,溶液中SO42-向正極移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)為了驗證 Fe2+與 Cu2+氧化性強弱,下列裝置能達到實驗目的的是_______(填裝置序號), 其正極的電極反應式為_______;若構建該原電池時兩個電極的質量相等,當導線中通過 0.4 mol 電子時,兩個電極的質量差為_______g。
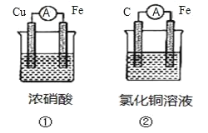
(2)將 CH4 設計成燃料電池,其利用率更高,裝置如圖所示(A、B 為多孔碳棒)。

實驗測得 OH- 定向移向 A 電極,則_______(填 A 或 B)處電極入口通 CH4,其電極反應式為_______。
(3)金屬冶煉和處理常涉及氧化還原反應。由下列物質冶煉相應金屬時采用電解法的是_______(填選 項字母)。
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com