
| A.物質燃燒可看成“儲存”在物質內部的能量轉化為熱能、光能等形式釋放出來 |
| B.綠色植物進行光合作用時,將太陽能轉化為化學能“貯存”起來 |
| C.生成物總能量一定低于反應物總能量 |
| D.破壞舊化學鍵吸收的能量大于形成新化學鍵釋放的能量時,該反應是吸熱反應 |
科目:高中化學 來源:不詳 題型:填空題
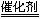 (3+2x)N2+6xH2O
(3+2x)N2+6xH2O
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.Q1<Q2 |
| B.生成物總能量均高于反應物總能量 |
| C.生成1molHCl氣體時放出Q1熱量 |
| D.1molHBr(g)具有的能量大于1molHBr(l)具有的能量 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.化學反應中化學鍵的斷裂和形成是反應過程中有能量變化的本質原因 | ||
| B.常溫常壓下,用惰性電極電解500mL飽和氯化鈉溶液時,若溶液的pH變為13時,則可產生的氣體體積為2.24L | ||
| C.NaHSO4溶液與Ba(OH)2溶液反應至中性的離子方程式為:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | ||
D.在保持常溫下,向醋酸溶液中不斷加入CH3COONa固體至溶液的PH=7,則醋酸的電離度減小,
|
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.能量變化是化學反應的基本特征之一 |
| B.化學反應中的能量變化主要是由化學鍵變化引起的 |
| C.化學反應中的能量變化的大小與反應物的質量多少有關 |
| D.物理變化中不存在能量變化 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.鹽酸和氫氧化鈉反應的中和熱△H=-57.3kJ?mol-1,則1molH2SO4和足量NaOH反應的反應熱△H=-57.3kJ?mol-1 |
| B.需要加熱才能發生的反應一定是吸熱反應 |
| C.1mol甲烷燃燒生成氣態水和二氧化碳所放出的熱量是甲烷的燃燒熱 |
| D.CO(g)的燃燒熱△H=-283.0kJ?mol-1,則反應2CO2(g)=2CO(g)+O2(g);△H=+2×283.0kJ?mol-1 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.a與b相比.b的活化能更高 |
| B.反應物斷鍵吸收的總能量小于生成物成鍵釋放的總能量 |
| C.a與b相比,反應的平衡常數一定不同 |
| D.a與b相比,a的反應速率更快 |

查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.稀醋酸與稀氫氧化鈉溶液發生中和反應的熱化學方程式為:CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l)△H=-57.3kJ/mol |
| B.在101kPa時1mol物質燃燒時的反應熱叫做該物質的燃燒熱 |
| C.未來氫氣作為新能源的其中一個優點是充分燃燒的產物不污染環境 |
| D.升高溫度或加入催化劑,可以改變化學反應的反應熱 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com