
【題目】CrO42-和Cr2O72-在溶液中可相互轉化。室溫下,1.0×10-3mol/L的Na2CrO4溶液中c(Cr2O72-)隨pH的變化如圖所示。

(1)用離子方程式表示Na2CrO4溶液中的可逆反應________________。
(2)調節該溶液的酸堿性使pH減小,觀察到實驗現象為_______________根據圖示中A點數據,計算出該轉化反應的平衡常數________;
(3)溫度升高,溶液中CrO42-的平衡轉化率減小,則該反應的ΔH____0(填“大于”、“等于”或“小于”)。
(4)在化學分析中采用K2CrO4為指示劑,以AgNO3標準溶液滴定待測液中的Cl-,利用Ag+與CrO42-生成磚紅色沉淀,作為滴定終點標志。當溶液中Cl-恰好沉淀完全(濃度等于1.0×10-5mol/L)時,溶液中c(Ag+)為____ mol/L,此時溶液中c(CrO42-)等于____ mol/L。(已知Ag2CrO4、AgCl的Ksp分別為2.0×10-12和2.0×10-10)。
【答案】2CrO42- + 2H+ ![]() Cr2O72-+ H2O 溶液由黃色變為橙色 1.0×10-5L3/mol3 小于 2.0×10-5 5.0×10-3
Cr2O72-+ H2O 溶液由黃色變為橙色 1.0×10-5L3/mol3 小于 2.0×10-5 5.0×10-3
【解析】
(1)隨著H+濃度的增大,CrO42轉化為Cr2O72的離子反應式為:2CrO42+2H+Cr2O72+H2O,
故答案為:2CrO42+2H+Cr2O72+H2O;
②溶液酸性增大,平衡2CrO42+2H+Cr2O72+H2O正向進行,CrO42的平衡轉化率增大,平衡正向移動,溶液由黃色變為橙色;A點Cr2O72的濃度為0.25×10-3mol/L,pH=1,H+濃度為1×101mol/L,則消耗的CrO42的濃度為0.5×10-3mol/L,則溶液中的c(CrO42)=1.0×10-3mol/L0.25×10-3mol/L×2=0.5×10-3mol/L,,此時該轉化反應的平衡常數為K=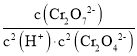 =
=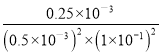 =1.0×10-5L3/mol3,
=1.0×10-5L3/mol3,
故答案為:溶液由黃色變為橙色;1.0×10-5L3/mol3;
(3)升高溫度,溶液中CrO42的平衡轉化率減小,平衡逆向移動,說明正方向放熱,則該反應的△H<0,
故答案為:小于;
(2)當溶液中Cl完全沉淀時,即c(Cl)=1.0×105mol/L,依據Ksp(AgCl)=2.0×1010,計算得到c(Ag+)=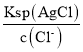 =
=![]() =2.0×105mol/L,
=2.0×105mol/L,
此時溶液中c(CrO42)=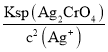 =
=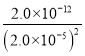 =5.0×103mol/L,
=5.0×103mol/L,
故答案為:2.0×105;5.0×103。


科目:高中化學 來源: 題型:
【題目】下列有關電解質溶液的說法正確的是
A.0.1mol/L氨水中滴入等濃度等體積的醋酸,溶液導電性增強
B.適當升高溫度,CH3COOH溶液pH增大
C.稀釋0.1 mol/L NaOH溶液,水的電離程度減小
D.CH3COONa溶液中加入少量CH3COOH,![]() 減小
減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硝酸亞鐵可用作媒染劑、分析試劑、催化劑等。
(1)硝酸亞鐵可用鐵屑在低溫下溶于稀硝酸制得,還原產物為NO。反應的化學方程式為________。
(2)某小組為探究硝酸亞鐵晶體的熱分解產物,按下圖所示裝置進行實驗。
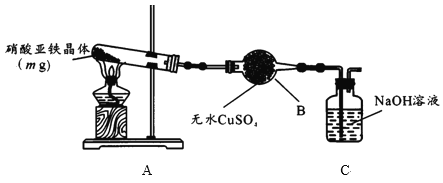
①儀器B的名稱是____,實驗中無水CuSO4變藍,由此可知硝酸亞鐵晶體含有___。
②實驗中觀察到A裝置的試管中有紅棕色氣體生成,檢驗熱分解后固體為氧化鐵的實驗方案為:
實驗步驟 | 現象 |
取少量固體加適量稀硫酸,振蕩,將溶液分成兩份 | 固體溶解得黃色溶液 |
一份滴入____ | 溶液變成紅色 |
另一份滴入1~2滴K3 [Fe(CN)6]溶液 | ___________ |
A中硝酸亞鐵晶體[Fe(NO3)2·xH2O]分解的化學方程式為______ 。
(3)繼續探究mg硝酸亞鐵晶體中鐵元素的質量分數
①取A中熱分解后的固體放入錐形瓶,用稀硫酸溶解,加入過量的KI溶液,滴入2滴___作指示劑。
②用a mol/LNa2S2O3標準溶液滴定錐形瓶中的溶液(已知:I2+2S2O32-=2I-+S4O62-),滴定至終點時用去bmLNa2S2O3溶液,則硝酸亞鐵晶體中鐵的質量分數為______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗小組對NaHSO3溶液分別與CuCl2、CuSO4溶液的反應進行探究。
實驗 | 裝置 | 試劑x | 操作及現象 |
Ⅰ |
| 1 mol·L1 CuCl2溶液 | 加入2mL CuCl2溶液,得到綠色溶液,30s時有無色氣泡和白色沉淀產生,上層溶液顏色變淺。 |
Ⅱ | 1 mol·L1 CuSO4溶液 | 加入2mL CuSO4溶液,得到綠色溶液,3分鐘未見明顯變化。 |
已知:Ⅰ.Cu2+![]() [Cu(NH3)4]2+(深藍色溶液)
[Cu(NH3)4]2+(深藍色溶液)
Ⅱ. Cu+![]() [Cu(NH3)]+(無色溶液)
[Cu(NH3)]+(無色溶液)![]() [Cu(NH3)4]2+(深藍色溶液)
[Cu(NH3)4]2+(深藍色溶液)
(1)推測實驗Ⅰ產生的無色氣體為SO2,實驗證實推測正確:用蘸有碘水的淀粉試紙接近試管口,觀察到_______,反應的離子方程式為_______。
(2)對實驗 Ⅰ 產生SO2的原因進行分析,提出假設:
假設a: Cu2+水解使溶液中c(H+)增大;
假設b: Cl-存在時,Cu2+與HSO3-反應生成CuCl白色沉淀,溶液中c(H+)增大。
① 假設a不合理,實驗證據是_______;
② 實驗表明假設b合理,實驗I反應的離子方程式有_____、H+ + HSO3- = SO2↑+H2O。
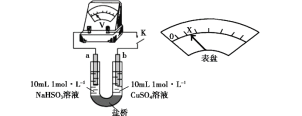
(3)對比實驗Ⅰ、Ⅱ,提出假設:Cl-增強了Cu2+的氧化性。
下述實驗Ⅲ證實了假設合理,裝置如圖。實驗方案:閉合K,電壓表的指針偏轉至“X”處;向U形管_______(補全實驗操作及現象)。
(4)將實驗Ⅱ的溶液靜置24小時或加熱后,得到紅色沉淀。經檢驗,紅色沉淀中含有Cu+、Cu2+和SO32。
①通過實驗Ⅳ證實紅色沉淀中含有Cu+和Cu2+。
實驗Ⅳ: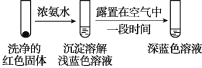
證實紅色沉淀中含有Cu+的實驗證據是_______;
②有同學認為實驗Ⅳ不足以證實紅色沉淀中含有Cu2+,設計實驗Ⅳ的對比實驗Ⅴ,證實了Cu2+的存在。實驗Ⅴ的方案和現象是:_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設![]() 為阿伏加德羅常數的值。下列說法正確的是
為阿伏加德羅常數的值。下列說法正確的是
A. 39gNa2O2與CO2完全反應,轉移的電子數為![]()
B. 6.0gNO和3.2gO2混合,所得氣體的分子數目為0.2![]()
C. 84gFe完全轉化為Fe3O4,失去的電子數為4![]()
D. 1molCu和2mol熱濃硫酸反應,生成SO2分子數目為![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】20℃,每100g水僅能溶解0.148gCa(OH)2。CaCO3在水中達到溶解平衡時,其Ksp為8.0×10-9(溶液密度近似為1g/cm3)。
(1)計算20℃時Ca(OH)2飽和溶液中的c(OH-);_________
(2)在10 mL Ca(OH)2飽和溶液中加入10mL0.10mol/L的K2CO3溶液,忽略溶液體積變化,通過計算判斷是否生成CaCO3沉淀_________,并求此時溶液中c(Ca2+)。__________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應中,調節反應物用量或濃度,不會改變反應產物的是( )
A.鐵在硫蒸氣中燃燒
B.H2SO4與Cu反應
C.二氧化硫通入澄清石灰水
D.硫酸中加入鋅粉
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有關![]() 分子結構的下列敘述中正確的是
分子結構的下列敘述中正確的是
①除苯環外的其余碳原子有可能都在一條直線上
②除苯環外的其余碳原子不可能都在一條直線上
③12個碳原子不可能都在同一平面上
④12個碳原子有可能都在同一平面上
A. ①② B. ②③ C. ①③ D. ②④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z、W四種短周期元素在周期表中的位置關系如右圖所示,X原子最外層有5個電子。下列說法正確的是
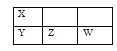
A.離子半徑:W< Z2B.還原性:Z2<W
C.酸性:H3YO4 >HXO3D.氫化物的穩定性:YH3> H2Z
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com