
【題目】Ⅰ.為防治碘缺乏病,通常在食鹽中添加少量的碘酸鉀(KIO3)。碘酸鉀和碘化鉀在溶液中能發生下列反應:KIO3+5KI+3H2SO4=3I2+3K2SO4+3H2O。
(1)用雙線橋標出電子轉移的方向和數目___。
(2)該反應中,氧化劑是___,還原劑是____。
Ⅱ.銅綠即是銅銹,它的化學成分是Cu2(OH)2CO3(堿式碳酸銅),銅在潮濕的空氣中生銹的化學反應為:2Cu+O2+CO2+H2O=Cu2(OH)2CO3。
(1)用單線橋標出電子轉移的方向和數目____。
(2)該反應中的還原劑是____、氧化劑是____。
Ⅲ.氮化鋁具有耐高溫、抗沖擊、導熱性好等優良性質,廣泛應用于電子工業、陶瓷工業等領域。在一定條件下,氮化鋁可以通過如下方式合成:Al2O3+N2+3C=2AlN+3CO
(1)用單線橋標出該反應中電子轉移的方向和數目___。
(2)該反應中的還原劑是___、氧化劑是____。
【答案】 KIO3 KI
KIO3 KI 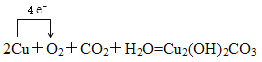 Cu O2
Cu O2 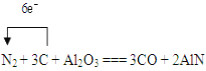 C N2
C N2
【解析】
Ⅰ.KIO3+5KI+3H2SO4=3I2+3K2SO4+3H2O,KIO3中碘元素化合價由+5降低為0,KI中氮元素化合價由-1升高為0;
Ⅱ.反應2Cu+O2+CO2+H2O=Cu2(OH)2CO3,Cu元素化合價由0升高為+2,O2中O元素化合價由0降低為-2;
Ⅲ. Al2O3+N2+3C=2AlN+3CO,N2中N元素化合價由0降低為-3,C元素化合價由0升高為+2;
Ⅰ.(1)KIO3+5KI+3H2SO4=3I2+3K2SO4+3H2O,KIO3中碘元素化合價由+5降低為0,KI中氮元素化合價由-1升高為0,電子轉移的方向和數目是 ;
;
(2)所含元素化合價降低的反應物為氧化劑,所含元素化合價升高的反應物為還原劑,KIO3中碘元素化合價由+5降低為0,所以KIO3是氧化劑;KI中氮元素化合價由-1升高為0,所以KI是還原劑;
Ⅱ. (1)反應2Cu+O2+CO2+H2O=Cu2(OH)2CO3,Cu元素化合價由0升高為+2,O2中O元素化合價由0降低為-2,電子轉移的方向和數目是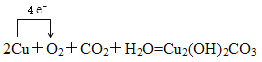 ;
;
(2)所含元素化合價降低的反應物為氧化劑,所含元素化合價升高的反應物為還原劑,Cu元素化合價由0升高為+2,所以Cu是還原劑;O2中O元素化合價由0降低為-2,所以O2是氧化劑;
Ⅲ. (1)反應Al2O3+N2+3C=2AlN+3CO,N2中N元素化合價由0降低為-3,C元素化合價由0升高為+2,電子轉移的方向和數目是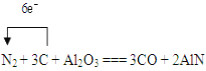 ;
;
(2)所含元素化合價降低的反應物為氧化劑,所含元素化合價升高的反應物為還原劑,C元素化合價由0升高為+2,所以C是還原劑;N2中N元素化合價由0降低為-3,所以N2是氧化劑;


科目:高中化學 來源: 題型:
【題目】在25℃時,H2R的鈉鹽溶液中,H2R、HR-、R2-分別在三者中所占的物質的量分數(ɑ)隨溶液pH變化關系如圖所示,下列敘述不正確的是

A. H2R屬于二元弱酸
B. pH=8時,溶液中c(Na+)>c(R2-)>c(HR-)>c(OH-)>c(H+)
C. 若c(H2R)+2c(R2-)+c(OH-)=c(H+),則pH一定小于2
D. 配制c(R2-)=c(HR-)的鈉鹽溶液應控制溶液的pH=7.2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】陽離子交換膜法電解飽和食鹽水具有綜合能耗低、環境污染小等優點。生產流程如下圖所示:

(1)電解飽和食鹽水的化學方程式為________。
(2)電解結束后,能夠脫去陽極液中游離氯的試劑或方法是________(填字母序號)。
a.Na2SO4b.Na2SO3
c.熱空氣吹出d.降低陽極區液面上方的氣壓
(3)食鹽水中的I—若進入電解槽,可被電解產生的Cl2氧化為ICl,并進一步轉化為IO3—。IO3—可繼續被氧化為高碘酸根(IO4—),與Na+結合生成溶解度較小的NaIO4沉積于陽離子交換膜上,影響膜的壽命。
①從原子結構的角度解釋ICl中碘元素的化合價為+1價的原因:________。
②NaIO3被氧化為NaIO4的化學方程式為________。
(4)在酸性條件下加入NaClO溶液,可將食鹽水中的I-轉化為I2,再進一步除去。通過測定體系的吸光度,可以檢測不同pH下I2的生成量隨時間的變化,如下圖所示。已知:吸光度越高表明該體系中c(I2)越大。

①結合化學用語解釋10 min時不同pH體系吸光度不同的原因:________。
②pH=4.0時,體系的吸光度很快達到最大值,之后快速下降。吸光度快速下降的可能原因:________。
③研究表明食鹽水中I-含量≤0.2 mgL-1時對離子交換膜影響可忽略。現將1m3含I-濃度為1.47 mgL-1 的食鹽水進行處理,為達到使用標準,理論上至少需要0.05 molL-1 NaClO溶液________L。(已知NaClO的反應產物為NaCl,溶液體積變化忽略不計)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】磷酸鐵鋰電池裝置如圖所示,其中正極材料橄欖石型LiFePO4通過粘合劑附著在鋁箔表面,負極石墨材料附著在銅箔表面,電解質為溶解在有機溶劑中的鋰鹽。電池工作時的總反應為:LiFePO4+6C ![]() Li1-xFePO4+LixC6,則下列說法正確的是
Li1-xFePO4+LixC6,則下列說法正確的是

A. 圖中聚合物隔膜是陰離子交換膜;
B. 充電時,Li+ 遷移方向是“由右向左”
C. 放電時,正極的電極反應式為LiFePO4—xe- = Li1-xFePO4 + xLi+
D. 用該電池電解精煉銅,當轉移電子1.25mol時能得到精銅32g,則電子利用率為80%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖為銅鋅原電池示意圖,下列說法正確的是

A. 鋅片逐漸溶解 B. 燒杯中溶液逐漸呈藍色
C. 電子由銅片通過導線流向鋅片 D. 該裝置能將電能轉變為化學能
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用15.8g高錳酸鉀氧化密度為1.19g/cm3、質量分數為36.5%的鹽酸以制取氯氣。反應如下:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
求:(1)生成Cl2在標況下的體積?____
(2)求鹽酸的濃度?____
(3)如果恰好完全反應,求所需鹽酸的體積?____
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下反應:A2(g)+3 B2(g)![]() 2 AB3(g) (每生成2 mol AB3放出92.4 kJ的熱量),在恒溫恒壓的密閉容器中進行如下實驗:①通入1 mol A2和3 mol B2,達平衡時放出熱量為Q1,②通入2 mol A2和6 mol B2,達平衡時放出熱量為Q2,則下列關系正確的是
2 AB3(g) (每生成2 mol AB3放出92.4 kJ的熱量),在恒溫恒壓的密閉容器中進行如下實驗:①通入1 mol A2和3 mol B2,達平衡時放出熱量為Q1,②通入2 mol A2和6 mol B2,達平衡時放出熱量為Q2,則下列關系正確的是
A.Q2 = 2 Q1 B.2Q1 < Q2
C.Q1 < Q2 < 92.4 kJ D.Q1 = Q2 < 92.4 kJ
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D分別是鹽酸、碳酸鈉、氯化鈣、硝酸銀四種溶液中的一種。將它們兩兩混合后,觀察到的現象如表所示(“↓”表示生成沉淀,“↑”表示生成氣體,“——”表示不反應)。請據此回答:

(1)寫出A、B、C溶液中溶質的名稱或化學式:
A__ B___ C____
(2)C和D反應的化學方程式為____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】肼(N2H4)在不同條件下分解產物不同,200℃時在Cu表面分解的機理如圖。已知200℃時:反應Ⅰ:3N2H4(g)=N2(g)+4NH3(g) ΔH1=-32.9 kJ·mol-1反應Ⅱ:N2H4(g)+H2(g)2NH3(g)ΔH2=-41.8 kJ·mol-1

下列說法不正確的是()
A. 圖所示過程①是放熱反應
B. 反應Ⅱ的能量過程示意圖如圖所示
C. 斷開3 mol N2H4(g)的化學鍵吸收的能量大于形成1 molN2(g)和4 mol NH3(g)的化學鍵釋放的能量
D. 200℃時,肼分解生成氮氣和氫氣的熱化學方程式為N2H4(g)=N2(g)+2H2(g)ΔH=+50.7 kJ·mol-1
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com