
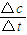 計算v(C),根據速率之比等于化學計量數之比計算v(A);
計算v(C),根據速率之比等于化學計量數之比計算v(A);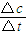 計算v(C),根據速率之比等于化學計量數之比計算v(B);
計算v(C),根據速率之比等于化學計量數之比計算v(B);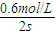 =0.3mol/(L?S),速率之比等于化學計量數之比,所以v(A)=
=0.3mol/(L?S),速率之比等于化學計量數之比,所以v(A)= v(C)=
v(C)= ×0.3mol/(L?S)=0.2mol/(L?S),故①正確;
×0.3mol/(L?S)=0.2mol/(L?S),故①正確; v(C)=
v(C)= ×0.3mol/(L?S)=0.1mol/(L?S),故②錯誤;
×0.3mol/(L?S)=0.1mol/(L?S),故②錯誤; △c(C)=
△c(C)= ×0.6mol/L=0.2mol/L,所以B平衡濃度為
×0.6mol/L=0.2mol/L,所以B平衡濃度為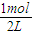 -0.2mol/L=0.3mol/L,故④錯誤;
-0.2mol/L=0.3mol/L,故④錯誤;

 小學能力測試卷系列答案
小學能力測試卷系列答案科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.①②③ | B.①③⑤ | C.②④⑤ | D.①③④ |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
(16分)向一定體積的密閉器中加入2 mol A、0.6 mo1 C和一定量的B三種氣體.一定條件下發生反應,各物質濃度隨時間變化如圖(Ⅰ)所示,其中t0~t1 階段c(B)未畫出.圖(Ⅱ)為t2時刻后改變反應條件,化學反應速率隨時間變化的情況,四個階段改變的條件均不相同,每個階段只改變濃度、溫度、壓強、催化劑中的一個條件,其中t3~t4階段為使用催化劑.
請回答下列問題:
(1)若t1=15 min,則t0~t1階段以C物質的濃度變化表示反應速率為 。
(2) t4~t5階段改變的條件為 ,B的起始物質的量濃度為 ,各階段平衡時對應的平衡常數如下表所示:
| t1~t2 | t2~t3 | t3~t4 | t4~t5 | t5~t6 |
| K1 | K2 | K3 | K4 | K5 |
則K1= (保留兩位小數),
K1、K2、K3、K4、K5之間的關系為 (用“>”、“<”或“=”連接).
(3) t5~t6階段保持容器內溫度不變,若A的物質的量共變化了0.01 mol,而此過程中容器與外界的熱交換總量為akJ,寫出此溫度下該反應的熱化學方程式
。
(4)在相同條件下,若起始時容器中加入a mol A、b mol B和c mol C,要達到t1時刻同樣的平衡,a、b、c要滿足的條件為 .
【解析】(1)化學反應速率通常用單位時間內濃度的變化量來表示。根據圖像I可知在15min內C的濃度變化量是0.6mol/L-0.3mol/L=0.3mol/L,所以速率為
(2)由圖像Ⅱ可知,在t4~t5階段反應速率減小,但平衡不移動,所以改變的條件不可能是溫度和濃度,由于在t3~t4階段為使用催化劑,所以該階段只是降低壓強。這說明改變壓強平衡不移動,因此反應前后體積是不變的。根據圖像I可知A是反應物,C是生成物,二者的變化量之比是2︰3,所以要使反應前后體積不變,B只是反應物,及反應的方程式為2A+B3C。C的濃度增加了0.3mol/L,則B的濃度減少了0.1mol/L,所以B的起始濃度是0.4mol/L+0.1mol/L=0.5mol/L。在t1~t2階段平衡是ABC的濃度(mol/L)分別為0.8、0.4、0.6,所以平衡常數為
![]() 。因為平衡常數只與溫度有關,根據圖像可知在t5~t6階段,正逆反應速率同時增大,但平衡向正反應方向移動,因為該條件只能是溫度且是升高溫度,所以反應是吸熱反應,因此K1、K2、K3、K4、K5之間的關系為K1=K2=K3=K4<K5。
。因為平衡常數只與溫度有關,根據圖像可知在t5~t6階段,正逆反應速率同時增大,但平衡向正反應方向移動,因為該條件只能是溫度且是升高溫度,所以反應是吸熱反應,因此K1、K2、K3、K4、K5之間的關系為K1=K2=K3=K4<K5。
(3)根據題意科判斷,每消耗0.01molA,反應就吸收能量akJ,所以反應的熱化學方程式為2A(g)+B(g)⇋3C(g) △H=+200kJ/mol。
(4)因為容器容積不變(容器容積是2L),所以要使平衡等效,則起始物質的物質的量是相等的。根據題意可知起始時AB的物質的量分別為2.4mol和1.2mol,則把cmol的C轉化為AB,則AB的物質的量(mol)分別是a+2c/3、b+c/3,所以關系式必須滿足a+2c/3=2.4、b+c/3=1.2.
查看答案和解析>>
科目:高中化學 來源:2012屆安徽省高二下學期第二次月考化學試卷(解析版) 題型:填空題
(16分) 向一定體積的密閉器中加入2 mol A、0.6 mo1 C和一定量的B三種氣體.一定條件下發生反應,各物質濃度隨時間變化如圖(Ⅰ)所示,其中t0~t1 階段c(B)未畫出.圖(Ⅱ)為t2時刻后改變反應條件,化學反應速率隨時間變化的情況,四個階段改變的條件均不相同,每個階段只改變濃度、溫度、壓強、催化劑中的一個條件,其中t3~t4階段為使用催化劑.

請回答下列問題:
(1)若t1=15 min,則t0~t1階段以C物質的濃度變化表示反應速率為 。
(2) t4~t5階段改變的條件為 ,B的起始物質的量濃度為 ,各階段平衡時對應的平衡常數如下表所示:
|
t1~t2 |
t2~t3 |
t3~t4 |
t4~t5 |
t5~t6 |
|
K1 |
K2 |
K3 |
K4 |
K5 |
則K1= (保留兩位小數),
K1、K2、K3、K4、K5之間的關系為 (用“>”、“<”或“=”連接).
(3) t5~t6階段保持容器內溫度不變,若A的物質的量共變化了0.01 mol,而此過程中容器與外界的熱交換總量為akJ,寫出此溫度下該反應的熱化學方程式
。
(4)在相同條件下,若起始時容器中加入a mol A、b mol B和c mol C,要達到t1時刻同樣的平衡,a、b、c要滿足的條件為 .
【解析】(1)化學反應速率通常用單位時間內濃度的變化量來表示。根據圖像I可知在15min內C的濃度變化量是0.6mol/L-0.3mol/L=0.3mol/L,所以速率為
(2)由圖像Ⅱ可知,在t4~t5階段反應速率減小,但平衡不移動,所以改變的條件不可能是溫度和濃度,由于在t3~t4階段為使用催化劑,所以該階段只是降低壓強。這說明改變壓強平衡不移動,因此反應前后體積是不變的。根據圖像I可知A是反應物,C是生成物,二者的變化量之比是2︰3,所以要使反應前后體積不變,B只是反應物,及反應的方程式為2A+B 3C。C的濃度增加了0.3mol/L,則B的濃度減少了0.1mol/L,所以B的起始濃度是0.4mol/L+0.1mol/L=0.5mol/L。在t1~t2階段平衡是ABC的濃度(mol/L)分別為0.8、0.4、0.6,所以平衡常數為
3C。C的濃度增加了0.3mol/L,則B的濃度減少了0.1mol/L,所以B的起始濃度是0.4mol/L+0.1mol/L=0.5mol/L。在t1~t2階段平衡是ABC的濃度(mol/L)分別為0.8、0.4、0.6,所以平衡常數為 。因為平衡常數只與溫度有關,根據圖像可知在t5~t6階段,正逆反應速率同時增大,但平衡向正反應方向移動,因為該條件只能是溫度且是升高溫度,所以反應是吸熱反應,因此K1、K2、K3、K4、K5之間的關系為K1=K2=K3=K4<K5。
。因為平衡常數只與溫度有關,根據圖像可知在t5~t6階段,正逆反應速率同時增大,但平衡向正反應方向移動,因為該條件只能是溫度且是升高溫度,所以反應是吸熱反應,因此K1、K2、K3、K4、K5之間的關系為K1=K2=K3=K4<K5。
(3)根據題意科判斷,每消耗0.01molA,反應就吸收能量akJ,所以反應的熱化學方程式為2A(g)+B(g)⇋3C(g) △H=+200kJ/mol。
(4)因為容器容積不變(容器容積是2L),所以要使平衡等效,則起始物質的物質的量是相等的。根據題意可知起始時AB的物質的量分別為2.4mol和1.2mol,則把cmol的C轉化為AB,則AB的物質的量(mol)分別是a+2c/3、b+c/3,所以關系式必須滿足a+2c/3=2.4、b+c/3=1.2.
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com