
氯氣常用于自來水廠殺菌消毒。
(1)工業上用鐵電極和石墨做為電極電解飽和食鹽水生產氯氣,鐵電極作 極,石墨電極上的電極反應式為 。
(2)氯氧化法是在堿性條件下,用Cl2將廢水中的CN-氧化成無毒的N2和CO2。該反應的離子方程式為 。
(3)氯胺(NH2Cl)消毒法是在用液氯處理自來水的同時通入少量氨氣,發生反應:Cl2 + NH3 = NH2Cl + HCl,生成的NH2Cl比HClO穩定,且能部分水解重新生成HClO,起到消毒殺菌的作用。
①氯胺能消毒殺菌的原因是 (用化學用語表示)。
②氯胺消毒法處理后的水中,氮元素多以NH4+的形式存在。
已知:NH4+(aq) + 1.5O2(g)= NO2-(aq) + 2H+(aq) + H2O (l) ΔH=-273 kJ·mol-1
NH4+(aq) + 2O2(g)= NO3-(aq) + 2H+(aq) + H2O (l) ΔH =-346 kJ·mol-1
NO2-(aq)被O2氧化成NO3-(aq)的熱化學方程式為 。
(4)在水產養殖中,可以用Na2S2O3將水中殘余的微量Cl2除去,某實驗小組利用下圖所示裝置和藥品制備Na2S2O3。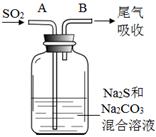

結合上述資料回答:
開始通SO2時,在B口檢測到有新的氣體生成,判斷從B口排出的氣體中是否含有H2S,并寫出判斷依據 。
為獲得較多的Na2S2O3,當溶液的pH接近7時,應立即停止通入SO2,其原因是 。
(1)陰 2Cl- - 2e- = Cl2↑
(2)5Cl2 + 2CN- + 4H2O = 10Cl- + N2↑+ 2CO2↑+ 8H +
(3)① NH2Cl+ H2O  NH3 + HClO(不寫可逆號扣1分)
NH3 + HClO(不寫可逆號扣1分)
② 2NO2- (aq) + O2(g) = 2NO3-(aq) ΔH = -146 kJ·mol-1(反應熱寫錯扣1分)
(4)①答案1:含H2S,由電離常數知H2SO3酸性強于H2S,溶液中的S2-與H2SO3反應生成H2S。
答案2:不含H2S,S2-還原性較強,能被SO2氧化生成其它含硫物質。
(只寫“含”或“不含”為0分)
②通入過多SO2會使溶液的pH小于7,S2O32-在酸性溶液中不能穩定存在。
解析試題分析:(1)工業上用鐵電極和石墨做為電極電解飽和食鹽水生產氯氣,鐵電極不能做陽極,如果做陽極,Fe-2e-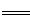 Fe2+,不會得到氯氣,所以鐵電極作陰極,石墨電極上的電極反應式為2Cl- - 2e- = Cl2↑。
Fe2+,不會得到氯氣,所以鐵電極作陰極,石墨電極上的電極反應式為2Cl- - 2e- = Cl2↑。
(2)氯氧化法是在堿性條件下,用Cl2將廢水中的CN-氧化成無毒的N2和CO2。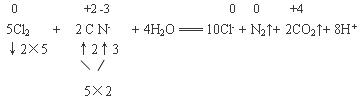
(3)①氯胺能消毒殺菌的原因是發生了水解NH2Cl+ H2O  NH3 + HClO,HClO具有強氧化性,能消毒殺菌。
NH3 + HClO,HClO具有強氧化性,能消毒殺菌。
②NH4+(aq) + 1.5O2(g)= NO2-(aq) + 2H+(aq) + H2O (l) ΔH=-273 kJ·mol-1 ①
NH4+(aq) + 2O2(g)= NO3-(aq) + 2H+(aq) + H2O (l) ΔH =-346 kJ·mol-1 ②
②×2-①×2得NO2-(aq)被O2氧化成NO3-(aq)的熱化學方程式為 2NO2- (aq) + O2(g) = 2NO3-(aq) ΔH = -146 kJ·mol-1;
(4)①開始通SO2時,在B口檢測到有新的氣體生成,判斷從B口排出的氣體中是否含有H2S,答案1:含H2S,由電離常數知H2SO3酸性強于H2S,溶液中的S2-與H2SO3反應生成H2S。
答案2:不含H2S,S2-還原性較強,能被SO2氧化生成其它含硫物質。
②為獲得較多的Na2S2O3,當溶液的pH接近7時,應立即停止通入SO2,其原因是通入過多SO2會使溶液的pH小于7,S2O32-在酸性溶液中不能穩定存在。
考點:本題考查化學綜合知識。


 世紀百通期末金卷系列答案
世紀百通期末金卷系列答案科目:高中化學 來源: 題型:填空題
煉金廢水中含有絡離子[Au(CN)2]+,其電離出的CN—有毒,CN-與H+結合生成HCN時,其毒性更強。回答下列問題:
(1)HCN的電離方程式為______________________NaCN溶液的pH_____7(填“< > =”)
(2)與弱電解質的電離方程式相似,[Au(CN)2]+也存在著兩步電離,其一級電離方程式為_________
(3)處理這種廢水是在堿性條件下,NaClO將CN—氧化為碳酸根和氮氣,其離子方程式為:__________
(4)在酸性條件下,ClO—也能氧化CN--,但實際處理廢水時卻不在酸性條件下進行的原因是_______________
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
某無色溶液X,由K+、NH4+、Ba2+、Al3+、Fe3+、CO32—、SO42—
中的若干種離子組成,取該溶液進行如下實驗: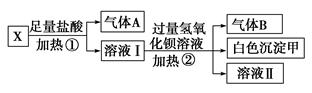
(1)白色沉淀甲是________。
(2)試寫出實驗過程中生成氣體A、B的離子方程式
__________________________、_______________________________
(3)通過上述實驗,可確定X溶液中一定存在的離子是
________,尚未確定是否存在的離子是________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
某溶液中可能含有OH-、CO32—、AlO2—、SiO32—、SO42—、K+、Na+、Fe3+、Mg2+、Al3+等離子,當向溶液中逐滴加入一定物質的量濃度的鹽酸時,生成沉淀的物質的量與加入鹽酸體積的關系如圖所示[已知:AlO2—+HCO3—+H2O=Al(OH)3↓+CO32—]。回答下列問題: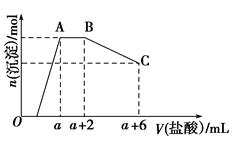
(1)原混合溶液中一定含有的離子是________;
(2)AB段反應的離子方程式是__________________________;
(3)AB段和鹽酸反應的離子與BC段和鹽酸反應的物質的物質的量之比為______________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
“探險隊員”——鹽酸,不小心走進了化學迷宮,不知怎樣走出來,因為迷宮有許多“吃人的野獸”(即能與鹽酸反應的物質或水溶液),鹽酸必須避開它們,否則就無法通過。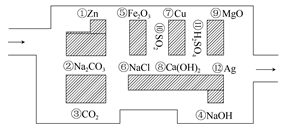
(1)請你幫助它走出迷宮 (請用圖中物質前的序號連接起來表示所走的路線)。
(2)在能“吃掉”鹽酸的化學反應中,屬于酸堿中和反應的有 個,屬于氧化還原反應的有 個,其中能“吃掉”鹽酸的鹽是 ,寫出該反應的離子方程式: 。
(3)在不能與鹽酸反應的物質中,屬于電解質的是 ,屬于非電解質的是 (填寫物質序號)。
(4)如果將鹽酸換成氯氣,它能沿著鹽酸走出的路線“走出”這個迷宮嗎?為什么? 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
由幾種離子化合物組成的混合物,含有以下離子中的若干種:K+、NH4+、Mg2+、Ba2+、Cl-、NO2-、SO42-、CO32-。將該混合物溶于水后得澄清溶液,現取4份100 mL該溶液分別進行如下實驗:
| 實驗 序號 | 實驗內容 | 實驗結果 |
| A | 加AgNO3溶液 | 有白色沉淀生成 |
| B | 加足量NaOH溶液并加熱 | 收集到氣體1.12 L(已折算成標準狀況下的體積) |
| C | 加足量BaCl2溶液,對所得沉淀進行洗滌、干燥、稱量;再向沉淀中加足量稀鹽酸,然后干燥、稱量 | 第一次稱量沉淀質量為6.27 g,第二次稱量沉淀質量為2.33 g |
| D | 加少量KMnO4酸性溶液 | KMnO4溶液褪色 |
| 陰離子符號 | 物質的量濃度(mol·L-1) |
| | |
| | |
| | |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
下面是同學們熟悉的物質:
①O2 ②金剛石 ③NaBr ④H2SO4 ⑤Na2CO3
⑥NH4Cl ⑦NaHSO4 ⑧Ne ⑨Na2O2 ⑩NaOH
(1)這些物質中,只含有共價鍵的是________;只含有離子鍵的是________;既含有共價鍵又含有離子鍵的是________;不存在化學鍵的是________。
(2)屬于共價化合物的是________;屬于離子化合物的是________。
(3)將NaHSO4溶于水,破壞了NaHSO4中的________,寫出其電離方程式_________________________;
NaHSO4在熔融狀態下電離,破壞了________,寫出其電離方程式____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
大氣中硫、氮的氧化物是形成酸雨的主要物質。某地酸雨中可能含有下列離子:Na+、Ba2+、NH4+、Al3+、Cl-、SO32-、SO42-、NO3-等。某研究小組取該地一定量的酸雨,濃縮后將所得澄清試液分成三份,進行如下實驗:
| 試樣 | 所加試劑 | 實驗現象 |
| 第一份試液 | 滴加適量的淀粉KI溶液 | 溶液呈藍色 |
| 第二份試液 | 滴加用鹽酸酸化的BaCl2溶液 | 有白色沉淀產生 |
| 第三份試液 | 滴加NaOH溶液,加熱,加入的NaOH溶液體積(V)與生成的沉淀、產生的氣體的物質的量(n)的關系如右圖 | 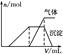 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
離子反應是中學化學中重要的反應類型,回答下列問題:
(1)在發生離子反應的反應物或生成物中,一定存在________(填編號)。
①單質 ②氧化物 ③電解質 ④鹽 ⑤化合物
(2)一種無色透明溶液中,可能含有下列離子: 、
、 、I-和Cl-,取該溶液進行如下實驗:
、I-和Cl-,取該溶液進行如下實驗:
①將溶液滴在藍色石蕊試紙上,呈紅色。
②將少許溶液濃縮后加入銅片和硫酸,有無色氣體析出,此氣體通空氣則立即變成紅棕色。
③取少許溶液滴入BaCl2溶液,則產生白色沉淀。
④取實驗③中的澄清溶液,滴入AgNO3試液,產生不溶于稀硝酸的白色沉淀。
⑤另取少許溶液,滴入NaOH溶液,有白色沉淀生成,當NaOH過量時,又有部分白色沉淀溶解。
根據以上現象判斷,原溶液中肯定不存在的離子是_______;肯定存在的離子是_______;不能作出判斷的離子是_______。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com