
【題目】為研究(NH4)2 SO4 和 NH4HSO4混合物樣品組成,稱取四份該樣品分別逐滴加入相同 濃度的 NaOH 溶液 40.0 mL,加熱并完全反應,產生 NH3的體積(已折算成標準狀況,
不考慮NH3在水中的溶解)如下表:
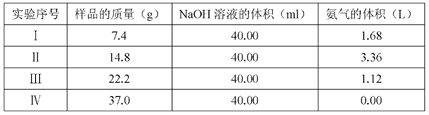
(1)樣品中(NH4)2 SO4和NH4HSO4的物質的量之比為_____________。
(2)NaOH 溶液的物質的量濃度為_________________________(精確到0.1)。
【答案】 1:4 5.0mol/L
【解析】(1)NH4HSO4電離方程式為NH4HSO4=NH4++H++SO42-,加入NaOH過程中先是發生H++OH-=H2O,然后發生NH4++OH-![]() NH3↑+H2O,由Ⅰ、Ⅱ組數據可知,Ⅰ中氫氧化鈉過量,所以按Ⅰ組數據計算完全反應的(NH4)2SO4和NH4HSO4;NH4HSO4電離方程式為NH4HSO4=NH4++H++SO42-,加入NaOH過程中先是發生H++OH-=H2O,然后發生NH4++OH-
NH3↑+H2O,由Ⅰ、Ⅱ組數據可知,Ⅰ中氫氧化鈉過量,所以按Ⅰ組數據計算完全反應的(NH4)2SO4和NH4HSO4;NH4HSO4電離方程式為NH4HSO4=NH4++H++SO42-,加入NaOH過程中先是發生H++OH-=H2O,然后發生NH4++OH-![]() NH3↑+H2O,按Ⅰ組數據:(NH4)2SO4和NH4HSO4,設n〔(NH4)2SO4〕和n(NH4HSO4)分別為x、y,依題意有x×132g/mol+ y×115 g/mol=7.4g,2x+y=
NH3↑+H2O,按Ⅰ組數據:(NH4)2SO4和NH4HSO4,設n〔(NH4)2SO4〕和n(NH4HSO4)分別為x、y,依題意有x×132g/mol+ y×115 g/mol=7.4g,2x+y=![]() ,解得x=0.0125mol、y=0.05mol,所以n((NH4)2SO4):n(NH4HSO4)=0.0125mol:0.05mol=1:4,故答案為:1:4;
,解得x=0.0125mol、y=0.05mol,所以n((NH4)2SO4):n(NH4HSO4)=0.0125mol:0.05mol=1:4,故答案為:1:4;
(2)應選NaOH已完全反應的第Ⅲ組,第Ⅳ組數據中氫離子可能未反應完全,應該根據Ⅲ的數據計算氫氧化鈉的濃度。22.2g樣品中共含:n(H+)=n(NH4HSO4)=0.05×![]() =0.15mol,據H++OH-=H2O知消耗NaOH 0.25 mol,據NH4++OH-
=0.15mol,據H++OH-=H2O知消耗NaOH 0.25 mol,據NH4++OH-![]() NH3↑+H2O知生成1.12L NH3消耗NaOH:
NH3↑+H2O知生成1.12L NH3消耗NaOH: ![]() =0.05mol,所以氫氧化鈉的物質的量為:0.15mol+0.05mol=0.2mol,根據c=
=0.05mol,所以氫氧化鈉的物質的量為:0.15mol+0.05mol=0.2mol,根據c=![]() =
=![]() = 5.0mol/L,故答案為:5.0mol/L。
= 5.0mol/L,故答案為:5.0mol/L。


科目:高中化學 來源: 題型:
【題目】第四周期有18種元素,其相關化合物在化工、醫藥、材料等領域均有著廣泛的應用。請回答下列問題:
(1)基態鈣原子核外電子云形狀為____________,電子占據的最高能層符號是____________。
(2)五氧化二釩(V2O5)是硫酸工業中重要的催化劑,基態釩原子的價電子排布式為____________。
(3)琥珀酸亞鐵片是用于缺鐵性貧血的預防和治療的常見藥物,其中“亞鐵”是關鍵成分,K3[Fe(CN)6]溶液是檢驗Fe2+的試劑,1molCN-中含π鍵的數目為____________,臨床建議服用維生素C促進“亞鐵”的吸收,避免生成Fe3+,從結構角度來看,Fe2+易被氧化成Fe3+的原因是____________。
(4)鎵、鍺、砷、硒的第一電離能由大到小的順序為____________(用元素符號表示);其中鍺的化合物四氯化鍺可用作光導纖維滲雜劑,其熔點為-49.5℃,沸點為83.1℃,則其晶體類型為____________,中心原子的雜化類型為____________;砷酸酸性弱于硒酸,從分子結構的角度解釋原因____________;砷化硼是一種新型材料,或成為最好的熱導體,其結構與金剛石相似,已知砷化硼晶胞參數為bpm,則該晶體的密度為____________ g ·cm-3。(NA表示阿伏加德羅常數的值)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】關于離子化合物的判斷不正確的是( )
A.無氧酸和含氧酸都不是離子化合物
B.氧化物都是離子化合物
C.堿和鹽不一定都是離子化合物
D.ⅠA、ⅡA族金屬和ⅥA、ⅦA族非金屬形成的化合物都是離子化合物。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】體積為V mL,密度為d g/mL的溶液,含有相對分子質量為M的溶質m g,其物質的量濃度為c mol/L,質量分數為w%,下列表達式正確的是( )
A. c=(w×1000×d)/M B. m=V×d×w
C. w%=(c×M)/(1000×d)% D. c=(1000×m)/(V×M)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】兩種元素原子的核外電子層數之比與最外層電子數之比相等,則在周期表的前10號元素中,滿足上述關系的元素共有( )
A.1對
B.2對
C.3對
D.4對
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D、E、F、G都是鏈狀有機物,它們的轉化關系如圖所示。A只含一種官能團,D的相對分子質量與E相差42,D的核磁共振氫譜圖上有3個峰,且峰面積之比為1:3:6:已知:Mr(R-Cl)-Mr(ROH)=18.5,,Mr表示相對分子質量。
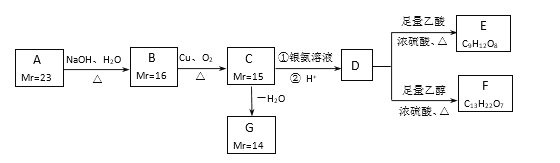
(1)A中含有的官能團符號是_________________。
(2)寫出D的分子式____________________________。
(3)下列有關A~G的說法正確的是_____________________。
a.每個A分子中含有官能團的數目為4個 b.B中所有官能團均發生反應生成C
c.C生成G只有1種產物 d.E中含有手性碳原子
(4)寫出B生成C的化學方程式______________________________________。
(5)芳香族化合物H與G互為同分異構體, 1mol H與足量氫氧化鈉溶液反應消耗2mol NaOH,且H苯環上的一氯代物只有兩種,寫出符合條件的H的結構簡式________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】“一碳化學”是指以含一個碳原子的化合物(如:CO2、CO、CH4、CH3OH等)為初始反應物,合成一系列重要的化工原料和燃料的化學。
(1)以CO2和NH3為原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反應可表示如下:
反應I:2NH3(g)+CO2(g)=NH2COONH4(s)△H1
反應II:NH2COONH4(s)=CO(NH2)2(s)+H2O(g) △H2=+72.49kJ/mol
總反應:2NH3(g)+CO2(g)==CO(NH2)2(s)+H2O(g) △H3=-86.98kJ/mol
請回答下列問題:
①反應I的△H1=______ kJ/mol
②反應II一般在_________(填“高溫”或“低溫”)情況下有利于該反應的進行。
③一定溫度下,在體積為固定的密閉容器中按計量比進行反應I,下列能說明反應達到了平衡狀態的是__________(填序號)。
A.混合氣體的平均相對分子質量不再變化 B.容器內氣體總壓強不再變化
C.2V正(NH3)=V逆(CO2) D.容器內混合氣體的密度不再變化
④環境為真空時,在一敞開容器(非密閉容器)中加入NH2COONH4固體,足夠長時間后,反應是否建立平衡狀態? ___________(填“是”或“否”)
(2)將CO2和H2充入一定體積的密閉容器中,在兩種溫度下發生反應:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。測得CH3OH的物質的量隨時間的變化如下圖。
CH3OH(g)+H2O(g)。測得CH3OH的物質的量隨時間的變化如下圖。
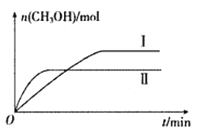
①曲線I.II對應的平衡常數大小關系為KI_______KII(填“ >”、“<”或“=”)。
②一定溫度下,在容積相同且固定的兩個密閉容器中,按如下方式加入反應物,一段時間后達到平衡。
容器 | 甲 | 乙 |
反應物投入量 | 1molCO2、3molH2 | amolCO2、bmolH2 cmol CH3OH(g)、cmolH2O(g)(a、b、c均不為零) |
若甲容器平衡后氣體的壓強為開始的0.8倍,則甲容器平衡混合氣體中CH3OH(g)的體積分數為_______,要使平衡后乙容器與甲容器中相同組分的體積分數相等,且起始時維持化學反應向逆反應方向進行,乙容器中c的取值范圍為________。
(3)以TiO2/Cu2Al2O4為催化劑,可以將CO2和CH4直接轉化成乙酸。在不同溫度下催化劑的催化效率與乙酸的生成速率的關系如下圖,乙酸的生成速率主要取決于溫度影響的范圍是________________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫時,研究pH對一定濃度FeSO4的穩定性的影響,根據下圖分析不合理的是:
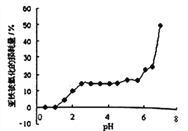
A. pH小于1時,亞鐵幾乎無損耗,可能的原因是4Fe2++O2+10H2O![]() 4Fe(OH)3+8H+平衡逆向移動
4Fe(OH)3+8H+平衡逆向移動
B. 其它條件相同時,FeSO4溶液中加入少量(NH4)2SO4固體,FeSO4的穩定性減弱
C. pH大于6.5時,亞鐵損耗量突變,可能的原因是生成的Fe(OH)2更易被氧化
D. pH在3.0~5.5之間,pH的變化對FeSO4穩定性影響不大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式書寫正確的是
A. 向Fe(OH)3中加入氫碘酸:Fe(OH)3+3H+=Fe3++3H2O
B. NH4HSO3溶液與足量的NaOH溶液混合加熱:NH4++HSO3-+2OH-![]() NH3↑+SO32-+2H2O
NH3↑+SO32-+2H2O
C. 酸性條件下KIO3溶液與KI溶液發生反應生成I2:IO3-+5I-+3H2O=3I2+6OH-
D. 向FeO中加入稀硫酸:2FeO + 8H+ + SO42- =2Fe3+ + SO2 ↑+ 4H2O
【答案】B
【解析】
Fe(OH)3具有氧化性、I—具有還原性,二者反應生成I2和Fe2+;NaOH溶液電離出的OH-,既與NH4+反應,又與HSO3-反應;酸性條件下溶液中不存在OH-;向FeO中加入稀硫酸,發生復分解反應。
Fe(OH)3具有氧化性、I-具有還原性,二者反應生成I2和Fe2+,離子方程式為2Fe(OH)3+2I-+6H+=2Fe2++6H2O+I2,A錯誤;NH4HSO3溶液與足量的NaOH溶液混合加熱,足量的NaOH溶液電離出的OH-,既與NH4+反應,又與HSO3-反應,方程式符合客觀事實,化學式書寫正確,電荷和原子都守恒,B正確;酸性條件下KIO3溶液與KI溶液發生反應生成I2,正確的離子方程式為:IO3-+5I-+6H+=3I2+3H2O,C錯誤;向FeO中加入稀硫酸, FeO與稀硫酸反應生成硫酸亞鐵和水,D錯誤。本題選B。
【點睛】
題考查了離子方程式的書寫,明確物質的性質、離子方程式書寫規則即可解答,注意掌握離子方程式正誤判斷常用方法:檢查反應能否發生,檢查反應物、生成物是否正確,檢查各物質拆分是否正確,如難溶物、弱電解質等需要保留化學式,檢查是否符合原化學方程式等。
【題型】單選題
【結束】
19
【題目】為鑒別K2CO3和NaHCO3兩種白色固體,有4位同學分別設計了四種不同的方法,其中不可行的是
A. 分別配成1mol/L的溶液,各取1mL滴加1滴酚酞試液,比較顏色深淺
B. 分別取樣在試管中加熱,將可能產生的氣體通入澄清石灰水,觀察有無白色渾濁
C. 分別取樣配成溶液,滴加Ba(OH)2溶液,觀察有無白色沉淀
D. 分別配成溶液,用鉑絲蘸取溶液在酒精燈火焰上灼燒,觀察火焰的顏色(必要時可透過藍色鈷玻璃)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com