
 乙二酸俗名草酸,下面是化學學習小組的同學對草酸晶體(H2C2O4•xH2O)進行的探究性學習的過程,請你參與并協助他們完成相關學習任務.
乙二酸俗名草酸,下面是化學學習小組的同學對草酸晶體(H2C2O4•xH2O)進行的探究性學習的過程,請你參與并協助他們完成相關學習任務.分析 (1)高錳酸鉀可氧化橡膠;
(2)高錳酸鉀溶液為紫色,滴定終點時溶液顯紫色;
(3)結合2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O及H2C2O4•xH2O的質量計算x;
①若滴定終點時俯視滴定管,消耗高錳酸鉀溶液的體積偏小;
②若滴定時所用的酸性KMnO4溶液因久置而導致濃度變小,消耗高錳酸鉀溶液的體積偏大,以此來解答.
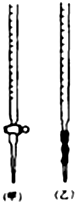
解答 解:(1)KMnO4標準溶液具有強氧化性,應裝在酸式滴定管中,選甲,故答案為:甲;
(2)本實驗滴定達到終點的標志是:最后一滴高錳酸鉀滴入后,錐形瓶內的溶液突然呈現紫色(或紫紅色),且半分鐘內溶液不褪色,
故答案為:當滴入最后一滴酸性KMnO4溶液時,溶液由無色變為紫色,且半分鐘內不褪色,即達滴定終點;
(3)由題給化學方程式及數據可知,1.260g純草酸晶體中含H2C2O4的物質的量為0.1000 mol/L×10.00 mL×10-3L/mL×5/2×100 mL/25 mL=0.0100 mol,則1.260 g H2C2O4•xH2O中含H2O的物質的量為$\frac{1.260g-0.0100mol×90g/mol}{18g/mol}$=0.0200 mol,則x=2,
故答案為:2;
①若滴定終點時俯視滴定管,則所得消耗酸性KMnO4溶液的體積偏小,由此所得n(H2C2O4)偏小,則n(H2O)偏大,x偏大,故答案為:偏大;
②若滴定時所用的酸性KMnO4溶液因久置而導致濃度變小,則消耗其體積偏大,所得x值偏小,故答案為:偏小.
點評 本題考查物質含量的測定實驗,為高頻考點,把握儀器的使用、氧化還原反應、實驗技能為解答關鍵,側重分析與實驗能力的考查,注意結合反應計算,題目難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | 2個 | B. | 3個 | C. | 4個 | D. | 5個 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
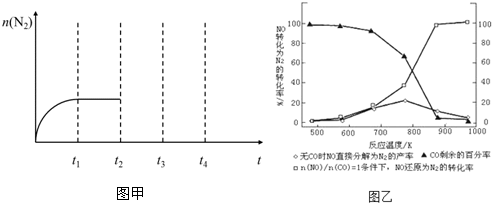
| A. | 1molN2與4molH2反應生成的NH3分子數為2NA | |
| B. | 14g乙烯和丙烯混合氣體中的氫原子數為2NA | |
| C. | 1 molFe溶于過量硝酸,電子轉移數為2NA | |
| D. | 標準狀況下,2.24LCCl4含有的共價鍵數為0.4NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
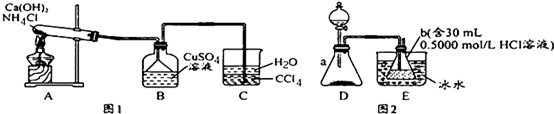
 堿式碳酸銅是一種化工原料,化學式用mCu(OH)2•nCuCO3表示.實驗室以廢銅屑為原料制取堿式碳酸銅的步驟如下:
堿式碳酸銅是一種化工原料,化學式用mCu(OH)2•nCuCO3表示.實驗室以廢銅屑為原料制取堿式碳酸銅的步驟如下:查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 實驗次數 | 初讀數(mL) | 末讀數(mL) |
| 1 | 0.00 | 18.50 |
| 2 | 0.00 | 22.45 |
| 3 | 0.00 | 18.48 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com