(2008?閔行區模擬)合成氨工業對國民經濟和社會發展具有重要的意義,合成氨氣所需的氫氣可以由水煤氣分離得到.涉及反應信息如下:
反應①:C(s)+H
2O(g)
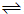
H
2(g)+CO(g) 平衡常數K
1反應②:平衡常數 K
2=
(1)K
1的表達式:K
1=
;反應②的化學方程式為
CO+H
2O
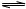
H
2+CO
2CO+H
2O
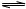
H
2+CO
2.
(2)在恒容時,對反應①,不能判斷該反應達到化學平衡狀態的是
D
D
(填序號).
A.容器中壓強不變 B.混合氣體中CO濃度不變
C.υ(H
2)
正=υ(H
2O)
逆 D.c(H
2O)=c(CO)
(3)將一定量的H
2O(g)和CO(g)分別通入到體積為1L的密閉容器中,在不同條件下進行反應,得到以下三組數據:
| 實驗組別 |
溫度/℃ |
起始量/mol |
平衡量/mol |
達到平衡所需時間/min |
| H2O |
CO |
H2 |
CO |
| 1 |
650 |
1 |
2 |
0.8 |
1.2 |
5 |
| 2 |
900 |
0.5 |
1 |
0.2 |
0.8 |
3 |
| 3 |
T |
a |
b |
c |
d |
t |
(Ⅰ)實驗1中,用CO
2表示反應開始到平衡的平均反應速率為
0.16mol/(L?min)
0.16mol/(L?min)
;
(Ⅱ)在實驗3,當a=0.5、b=1時,要使c、d數據與實驗2相同,且t<3,可以采取的措施為
D
D
(填序號)
A.其它條件不變溫度T<900℃B.其它條件不變溫度T>900℃
C.充入一定量氖氣 D.使用高效催化劑
(Ⅲ)對于反應②,當升高溫度時K
2減小
減小
(填“增大”、“減小”或“不變”).

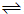 H2(g)+CO(g) 平衡常數K1
H2(g)+CO(g) 平衡常數K1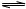 H2+CO2
H2+CO2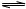 H2+CO2
H2+CO2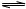 H2+CO2,故答案為:
H2+CO2,故答案為: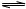 H2+CO2;
H2+CO2;

 智能訓練練測考系列答案
智能訓練練測考系列答案



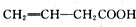
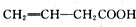


 ;
;
