

分析 (1)通入甲醇的一極為原電池的負極,發生氧化反應,甲醇在堿性條件下被氧化生成碳酸根離子;
(2)工作一段時間后,斷開K,此時A、B兩極上產生的氣體體積相同,分析電極反應,B為陰極,溶液中銅離子析出,氫離子得到電子生成氫氣;A電極為陽極,溶液中的氫氧根離子失電子生成氧氣;陽極電極反應和電子守恒計算得到;
(3)C電極為陽極,D電極為陰極,根據丙圖可知溶液中有三種金屬陽離子,而根據丙的成分可知溶液中只有兩種金屬陽離子,說明在電解過程中還有Cu2+生成,因此C電極是Cu做陽極,D電極是石墨做陰極,根據轉移電子的物質的量和金屬陽離子的物質的量的變化確定曲線對應的離子,結合轉移電子的物質的量計算.
解答 解:(1)甲醇燃料電池是原電池反應,甲醇在負極失電子發生氧化反應,電極反應為:CH3OH-6e-+8OH-=CO32-+6H2O,
故答案為:CH3OH-6e-+8OH-=CO32-+6H2O;
(2)工作一段時間后,斷開K,此時A、B兩極上產生的氣體體積相同,分析電極反應,B為陰極,溶液中銅離子析出,氫離子得到電子生成氫氣,設生成氣體物質的量為X,溶液中銅離子物質的量為0.1mol,電極反應為:
Cu2++2e-=Cu,
0.1mol 0.2mol
2H++2e-=H2↑,
2x x
A電極為陽極,溶液中的氫氧根離子失電子生成氧氣,電極反應為:
4OH--4e-=2H2O+O2↑,
4x x
根據得失電子守恒得到0.2+2x=4x,
x=0.1mol
乙中A極析出的氣體是氧氣,物質的量為0.1mol,在標準狀況下的體積為2.24L,
故答案為:2.24L;
(3)根據轉移電子的物質的量和金屬陽離子的物質的量的變化,可知,銅離子從無增多,鐵離子物質的量減小,亞鐵離子增加,故①為Fe3+,②為Fe2+,③為Cu2+,
由圖可知電子轉移為0.4mol,生成Cu2+物質的量為0.2mol,陰極電極反應Fe3++e-=Fe2+,反應結束后,溶液中有Fe2+為0.5mol,Cu2+為0.2mol,所以需要加入NaOH溶液0.5×2+0.2×2=1.4mol,所以所需NaOH溶液的體積為$\frac{1.4}{5}$=0.28L=280mL,
故答案為:Fe2+;280.
點評 本題綜合原電池電解原理以及級原電池知識,為高頻考點,綜合性強,難度大,主要考查學生分析問題的能力,是高考的熱點習題,答題時注意體會電極方程式的書寫.


科目:高中化學 來源: 題型:選擇題
| A. | 將二氧化硫通入品紅溶液,溶液顯紅色,加熱后變為無色 | |
| B. | 向溶液中加入新制氯水,再滴加KSCN溶液,若溶液變紅,則證明原溶液中一定含有Fe2+ | |
| C. | 將濕潤的紅紙條放進盛有氯氣的集氣瓶中,紅紙條褪色 | |
| D. | 向酸性高錳酸鉀溶液中滴加Na2SO3溶液,溶液無明顯變化 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向某溶液中加入稀硝酸酸化,再滴入BaCl2溶液,產生白色沉淀,則原溶液中一定有SO42- | |
| B. | 向某溶液中加入稀硫酸酸化,再滴入AgNO3溶液,產生白色沉淀,則原溶液中一定有Cl- | |
| C. | 向某溶液中加入碳酸鈉溶液,產生白色沉淀,再滴入稀鹽酸,沉淀溶解,則原溶液中一定有Ca2+ | |
| D. | 用光潔的鉑絲蘸取某無色溶液,在酒精燈外焰里灼燒時觀察到黃色火焰,則原溶液中一定有Na+ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 鉛蓄電池的電池總反應式為:
鉛蓄電池的電池總反應式為:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
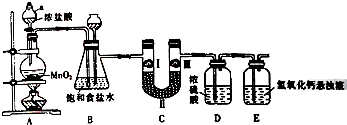 氯氣在工農業生產在應用非常廣泛.如圖是實驗室制備氯氣并進行一系列相關實驗的裝置.
氯氣在工農業生產在應用非常廣泛.如圖是實驗室制備氯氣并進行一系列相關實驗的裝置.| 選項 | a | b | c |
| Ⅰ | 濕潤的有色布條 | 濕潤的有色布條 | 濕潤的有色布條 |
| Ⅱ | 堿石灰 | 濃硫酸 | 無水氯化鈣 |
| Ⅲ | 濕潤的有色布條 | 干燥的有色布條 | 干燥的有色布條 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,22.4 LHF中分子總數為NA | |
| B. | 室溫下,31.0g白磷中含有的共價鍵數目為1.5NA | |
| C. | 常溫常壓下,17 g甲基(-14CH3)所含的電子數為9NA | |
| D. | .將1molCl2通入到水中,則N(HClO)+N(Cl-)+N(ClO-)=2NA |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com