
碘(I)元素與氧元素可以形成多種化合物,其中一種為碘酸碘。在該化合物中,碘元素呈+3和+5兩種價態,則這種化合物的化學式是
A.I2O5 B.I2O7 C.I4O5 D.I4O9
 期末復習檢測系列答案
期末復習檢測系列答案 超能學典單元期中期末專題沖刺100分系列答案
超能學典單元期中期末專題沖刺100分系列答案 黃岡360度定制密卷系列答案
黃岡360度定制密卷系列答案 陽光考場單元測試卷系列答案
陽光考場單元測試卷系列答案科目:高中化學 來源: 題型:閱讀理解
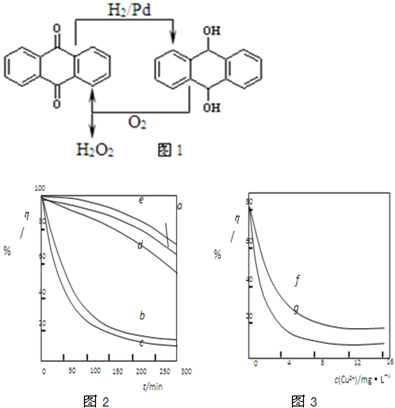
| ||
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
| 實驗步驟 | 預期現象與結論 |
步驟1:取少量上述溶液注入試管中,滴入幾滴淀粉溶液振蕩. |
若溶液顯 藍色 藍色 ,則假設1成立;否則,假設1不成立,再進行步驟2 |
步驟2: 取少量上述溶液注入試管中 取少量上述溶液注入試管中 滴入幾滴1.0mol?L-1H2SO4溶液和幾滴3%H2O2溶液 滴入幾滴1.0mol?L-1H2SO4溶液和幾滴3%H2O2溶液 再滴入幾滴淀粉溶液,振蕩 再滴入幾滴淀粉溶液,振蕩 |
若溶液顯藍色,則假設2成立,反應的離子方程式為 2I-+H2O2+2H+=I2+2H2O 2I-+H2O2+2H+=I2+2H2O ;否則,假設2不成立,再進行步驟3 |
步驟3: 取少量上述溶液注入試管中 取少量上述溶液注入試管中 滴入幾滴1.0mol?L-1NaHSO3溶液 滴入幾滴1.0mol?L-1NaHSO3溶液 再滴入幾滴淀粉溶液,振蕩 再滴入幾滴淀粉溶液,振蕩 |
若溶液呈藍色,則假設3成立 若溶液呈藍色,則假設3成立 否則,假設3不成立 否則,假設3不成立 |
查看答案和解析>>
科目:高中化學 來源: 題型:

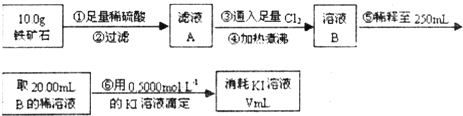
查看答案和解析>>
科目:高中化學 來源:2013-2014學年安徽省濉溪縣高三第四次月考化學試卷(解析版) 題型:實驗題
碘是人體必需的微量元素之一,有“智力元素”之稱。食用加碘食鹽可預防碘缺乏病。查閱資料知:①在酸性條件下,I- 能被NO3- 氧化成IO3-,被H2O2或O2等氧化為I2;② IO3- 能被HSO3- 還原成I2。
請你利用實驗室常用儀器和下列限選試劑,依次研究某食鹽樣品中所加碘的存在形式是I2、I-、IO3- 中的哪一種。
限選試劑如下:1.0 mol∙L-1HNO3溶液、1.0 mol∙L-1H2SO4溶液、1.0 mol∙L-1NaHSO3溶液、3%H2O2溶液、1%淀粉溶液、蒸餾水。
(1)提出假設
假設1:該食鹽樣品中含I2;
假設2:該食鹽樣品中含I-;
假設3: 。
(2)設計方案與實驗探究
將適量食鹽樣品溶于蒸餾水制成溶液,請按要求填寫下表:
|
實驗步驟 |
預期現象與結論 |
|
步驟1:取少量上述溶液注入試管中,滴入幾滴淀粉溶液,振蕩 |
若溶液顯 (填顏色),則假設1成立;否則,假設1不成立,再進行步驟2 |
|
步驟2:
|
若溶液顯藍色,則假設2成立,反應的離子方程式為 ;否則,假設2不成立,再進行步驟3 |
|
步驟3:
|
|
(3)問題與思考
純KIO3或純KI都可以作為食用加碘鹽中碘的來源。從化學角度來看,實驗中添加 (填“KIO3”或“KI”)更好,理由是 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com