
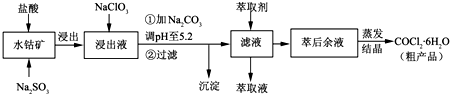
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 開始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |


科目:高中化學 來源: 題型:閱讀理解

查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
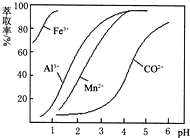
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | 開始沉淀 | 2.3 | 7.5 | 7.6 | 3.4 | 完全沉淀 | 4.1 | 9.7 | 9.2 | 5.2 |
查看答案和解析>>
科目:高中化學 來源: 題型:
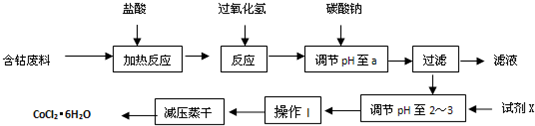
| 化學式 | 溶度積(室溫時)Ksp | 沉淀完全時的pH | 氯化鈷晶體的性質 |
| Co(OH)2 | 5.9×10-15 | 9.4 | CoCl2?6H2O呈紅色,常溫下穩定.110°C~120°C時脫水變成藍色無水氯化鈷 |
| Fe(OH)2 | 1.6×10-14 | 9.6 | |
| Fe(OH)3 | 1.0×10-35 | x |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解

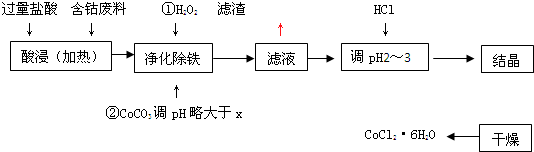
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 開始沉淀 | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀 | 4.0 | 9.7 | 9.2 | 5.2 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com