



 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:

查看答案和解析>>
科目:高中化學 來源: 題型:
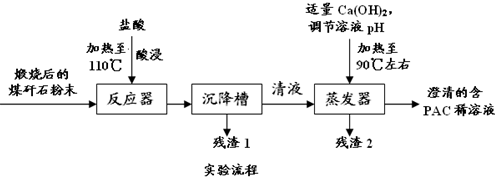
查看答案和解析>>
科目:高中化學 來源: 題型:
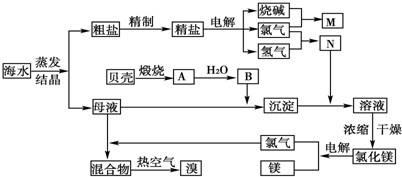
2- 4 |
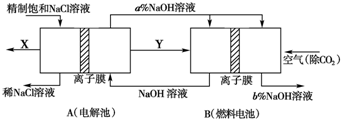
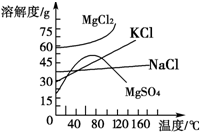
查看答案和解析>>
科目:高中化學 來源:2013屆浙江省溫州市龍灣中學高三上學期期初考試化學試卷(帶解析) 題型:填空題
(10)(1)氯堿工業是利用電解食鹽水生產 ① 為基礎的工業體系。
(2)電解前,為除去食鹽水中的Mg2+、Ca2+、 等雜質離子,下列加入順序合理的是 ②。
等雜質離子,下列加入順序合理的是 ②。
| A.碳酸鈉、氫氧化鈉、氯化鋇 | B.碳酸鈉、氯化鋇、氫氧化鈉 |
| C.氫氧化鈉、碳酸鈉、氯化鋇 | D.氯化鋇、氫氧化鈉、碳酸鈉 |
| 成分 | NaCl | Mg(OH)2 | CaCO3 | BaSO4 | 其他不溶于酸的物質 |
| 質量分數(%) | 15~20 | 15~20 | 5~10 | 30~40 | 10~15 |

查看答案和解析>>
科目:高中化學 來源:2012-2013學年浙江省溫州市高三上學期期初考試化學試卷(解析版) 題型:填空題
(10)(1)氯堿工業是利用電解食鹽水生產 ① 為基礎的工業體系。
(2)電解前,為除去食鹽水中的Mg2+、Ca2+、 等雜質離子,下列加入順序合理的是 ② 。
等雜質離子,下列加入順序合理的是 ② 。
A.碳酸鈉、氫氧化鈉、氯化鋇 B.碳酸鈉、氯化鋇、氫氧化鈉
C.氫氧化鈉、碳酸鈉、氯化鋇 D.氯化鋇、氫氧化鈉、碳酸鈉
(3)“鹽泥”是粗鹽提純及電解食鹽水過程中形成的工業“廢料”。某工廠的鹽泥組成如下:
|
成分 |
NaCl |
Mg(OH)2 |
CaCO3 |
BaSO4 |
其他不溶于酸的物質 |
|
質量分數(%) |
15~20 |
15~20 |
5~10 |
30~40 |
10~15 |
為生產七水硫酸鎂,設計了以下工藝流程:
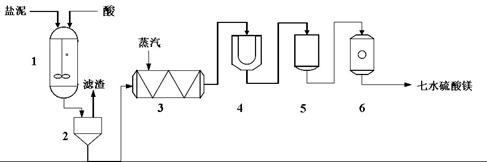
生產七水硫酸鎂工藝流程圖
1-反應器 2-過濾器 3-蒸發濃縮器 4-結晶槽 5-洗滌槽 6-真空干燥器
裝置1中加入的酸應選用 ③ ,加入的酸應適當過量,控制pH為5左右,反應溫度在50℃左右。持續攪拌使之充分反應,以使Mg(OH)2充分溶解并轉化為MgSO4,在此過程中同時生成CaSO4。其中碳酸鈣可以轉化為硫酸鈣的原因是 ④ 。
裝置2中濾渣的主要成分為 ⑤ 。
裝置3中通入高溫水蒸汽并控制溫度在100~110℃,蒸發結晶,此時析出的晶體主要是__⑥__。
用裝置6(真空干燥器)干燥七水硫酸鎂晶體的理由是 ⑦ 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com