
【題目】海水是一個巨大的化學資源寶庫,下圖是海水綜合利用的部分工業流程圖:
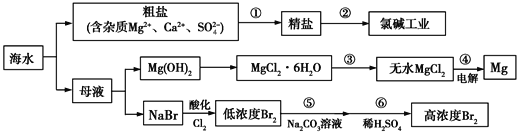
Ⅰ.在過程①中應加入的試劑分別為A.Na2CO3溶液、B.鹽酸、C.BaCl2溶液、D.NaOH溶液,這4種試劑添加的合理順序是____(填序號);過程①中須完成的實驗操作分別為a.多步過濾、b.蒸發濃縮、c.冷卻結晶,操作a中需要的玻璃儀器是燒杯、__________。
Ⅱ.(1)氯堿工業的反應原理是電解飽和食鹽水,下列物質不可能是氯堿工業產品的是____。
A.H2 B.Cl2 C.Na2CO3 D.NaOH
(2)如圖所示是離子交換膜法電解原理示意圖,兩極均用惰性電極材料。精制飽和食鹽水進入陽極室,H+在右電極上發生____反應(填“氧化”或“還原”),所使用的離子交換膜的主要作用是____________。

(3)操作人員欲用pH試紙測定右室溶液酸堿度,其操作方法為________。
Ⅲ.過程④制取金屬鎂的化學方程式為MgCl2(熔融)![]() Mg+Cl2↑。簡述工業上不使用電解MgO制取金屬鎂的原因:___。
Mg+Cl2↑。簡述工業上不使用電解MgO制取金屬鎂的原因:___。
Ⅳ.過程⑤用純堿溶液吸收Br2,發生的主要反應為:3Br2+3Na2CO3=5NaBr+NaBrO3+3CO2↑,則吸收1 mol Br2,轉移的電子數為____mol。
【答案】DCAB或CDAB或CADB普通漏斗和玻璃棒C還原防止OH-與Cl2反應,凈化所得的NaOH溶液將一小塊pH試紙放在表面皿上,用玻璃棒蘸取少量待測液,點在pH試紙上,再與標準比色卡對照MgO的熔點遠高于MgCl2的熔點![]()
![]()
【解析】
海水曬鹽后得到粗鹽和母液,粗鹽加入氫氧化鈉、氯化鋇、碳酸鈉、鹽酸精制除雜得到精鹽,電解飽和食鹽水得到氯氣、氫氣和氫氧化鈉溶液,母液中加入氫氧化鈣濁液沉淀鎂離子,過濾得到氫氧化鎂沉淀,加入鹽酸溶解后得到氯化鎂溶液,蒸發濃縮,冷卻結晶,過濾洗滌得到氯化鎂晶體,在氯化氫氣流中加熱失水得到氯化鎂固體,電解熔融氯化鎂得到金屬鎂和氯氣,濾液中加入氯氣氧化溴離子得到溴單質的低濃度溶液,加入碳酸鈉溶液吸收溴單質,再加入稀硫酸,發生歸中反應得到高濃度的溴單質溶液。
Ⅰ.除去粗鹽中的可溶性雜質:Ca2+、Mg2+、Fe3+、SO42-時,可以加入過量NaOH(去除鎂離子):Mg2++2OH-=Mg(OH)2↓,加入過量BaCl2(去除硫酸根離子):SO42-+Ba2+=BaSO4↓;也可先加氯化鋇后加氫氧化鈉,再加入過量Na2CO3(去除鈣離子以及多余的鋇離子):Ca2++CO32-=CaCO3↓,Ba2++CO32-=BaCO3↓,碳酸鈉必須加在氯化鋇之后,鹽酸在最后,除去多余的碳酸根離子,所以按滴加順序依次為DCAB或CDAB或CADB;過程①中實驗操作a中為多步過濾,需要的玻璃儀器是燒杯、普通漏斗和玻璃棒;
Ⅱ.(1)根據質量守恒定律可知化學反應前后元素的種類一定不變,反應物是氯化鈉和水,所以反應后的物質中只能含有鈉、氯、氫和氧四種元素。A.氫氣是由氫元素組成的,符合以上關于產物情況的分析,所以氫氣可能是該反應的生成物,選項A不選;B.氯氣由氯元素組成,符合以上關于產物情況的分析,所以氯氣可能是該反應的生成物,選項B不選;C.碳酸鈉是由碳、氧和鈉三種元素組成,由以上分析可知生成物中不可能含有碳元素,所以生成物中不可能含有碳酸鈉,選項C選;D.氫氧化鈉是由鈉、氧和氫三種元素組成,符合以上關于產物情況的分析,所以可能是生成物,選項D不選。答案選C;(2)由于氯離子在左邊電極上被氧化成氯氣,所以精制飽和食鹽水進入陽極室,右邊電極連接直流電源的負極,H+在右電極上發生還原反應,所使用的離子交換膜的主要作用是防止OH-與Cl2反應,凈化所得的NaOH溶液;(3)測定溶液pH的操作方法為:將一小塊pH試紙放在表面皿上,用玻璃棒蘸取少量待測液,點在pH試紙上,再與標準比色卡對照;
Ⅲ.由于MgO的熔點遠高于MgCl2的熔點,如果電解MgO會浪費大量能源,故工業上采用電解MgCl2的方法制取金屬鎂;
Ⅳ.根據反應3Br2+3Na2CO3=5NaBr+NaBrO3+3CO2↑可知,只有溴元素化合價發生了變化,每吸收3mol Br2,轉移的電子數為5mol,則吸收1 mol Br2,轉移的電子數為![]() mol。
mol。


科目:高中化學 來源: 題型:
【題目】鐵及其化合物之間的相互轉化可用下式表示:
![]()
回答下列有關問題:
(1)鐵元素在周期表中的位置是_____________.
(2)Fe與過量稀硫酸反應可以制取FeSO4.若用反應所得的酸性溶液,實現上述①的轉化,要求產物純凈,可選用的試劑是__________--(選填序號).
A.Cl2B.FeC.HNO3D.H2O2
(3)上述轉化得到的硫酸鐵可用于電化浸出黃銅礦精礦工藝.精礦在陽極浸出的反應比較復雜,其中有一主要反應CuFeS2+4Fe3+=Cu2++5Fe2++2S(CuFeS2中S為-2價),下列說法正確的是_____(選填序號).
A.從物質分類的角度看,黃銅礦屬于合金
B.反應中,所有鐵元素均被還原
C.反應中,CuFeS2既作氧化劑又作還原劑
D.當轉移1mol電子時,46gCuFeS2參加反應
(4)下述反應中,若FeSO4和O2的系數比為2:1,試配平下列方程式:_______FeSO4+_______K2O2→_______K2FeO4+_______K2O+ _______K2SO4+_______O2↑
_____________
(5)某同學將鐵與水蒸氣高溫反應后的固體物質溶解在過量鹽酸中,如何判斷所得溶液中是否含有Fe3+? _____________________________________
(6)向含4 mol HNO3的稀溶液中逐漸加入鐵粉至過量,假設生成的氣體只有一種,請在坐標系中畫出n(Fe2+)隨n(Fe)變化的示意圖,并在途中標出各點的坐標值。______________

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在氯水中存在多種分子和離子,它們在不同的反應中表現出各自的性質。下列實驗現象和結論一致且正確的是( )
A. 加入有色布條,一會兒有色布條褪色,說明溶液中有Cl2存在
B. 溶液呈淺黃綠色,且有刺激性氣味,說明有Cl2分子存在
C. 用鹽酸酸化后,滴入AgNO3溶液產生白色沉淀,說明氯水中有Cl-存在
D. 加入NaOH溶液,氯水黃綠色消失,說明有HClO分子存在
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】從石器、青銅器到鐵器時代,金屬的冶煉體現了人類文明的發展水平。下列有關金屬冶煉的說法正確的是

A. 肯定發生的是置換反應
B. 肯定發生的是氧化還原反應
C. 只能用金屬作還原劑冶煉金屬
D. 如圖表示了三種金屬被人類開發利用的大致年限,之所以有先后,主要取決于金屬在地殼中的含量多少
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】海藻中含有豐富的、以離子形式存在的碘元素。下圖是實驗室從海藻里提取碘的流程中的一部分。
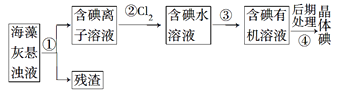
下列判斷正確的是
A. 步驟①③的操作分別是過濾、萃取
B. 可用淀粉溶液檢驗步驟②的反應是否進行完全
C. 步驟③中加入的有機溶劑是裂化汽油或乙醇
D. 步驟④的操作是過濾
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以煤為原料,經過化學加工使煤轉化為氣體、液體、固體燃料以及各種化工產品的工業叫煤化工。
(1)將水蒸氣通過紅熱的炭即可產生水煤氣。反應為C(s)+H2O(g)CO(g)+H2(g) ΔH=+131.3 kJ·mol-1。
①該反應在常溫下_______(填“能”或“不能”)自發進行。
②一定溫度下,在一個容積可變的密閉容器中,發生上述反應,下列能判斷該反應達到化學平衡狀態的是____(填字母,下同)。
a.容器中的壓強不變
b.1 mol H—H鍵斷裂的同時,斷裂2 mol H—O鍵
c.c(CO)=c(H2)
d.密閉容器的容積不再改變
(2)將不同量的CO(g)和H2O(g)分別通入體積為2 L的恒容密閉容器中,進行反應CO(g)+H2O(g)CO2(g)+H2(g),得到如下三組數據:
實驗組 | 溫度/℃ | 起始量/mol | 平衡量/mol | 達到平衡所需時間/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 6 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①實驗1中從反應開始至平衡以CO2表示的平均反應速率為v(CO2)=________(取小數點后兩位,下同)。
②該反應的正反應為________(
(3)目前工業上有一種方法是用CO2來生產甲醇。一定條件下發生反應:CO2(g)+3H2(g)CH3OH(g)+H2O(g),如圖表示該反應進行過程中能量(單位為kJ·mol-1)的變化。在體積為1 L的恒容密閉容器中,充入1 mol CO2和3 mol H2,達到平衡后下列措施中能使c(CH3OH)增大的是________。

a.升高溫度
b.充入He(g),使體系壓強增大
c.將H2O(g)從體系中分離出來
d.再充入1 mol CO2和3 mol H2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】世界環保聯盟建議全面禁止使用氯氣用于飲用水的消毒,而建議采用高效“綠色”消毒劑二氧化氯。二氧化氯是一種極易爆炸的強氧化性氣體,易溶于水、不穩定、呈黃綠色,在生產和使用時必須盡量用稀有氣體進行稀釋,同時需要避免光照、震動或加熱。實驗室以電解法制備ClO2的流程如下:

(1) ClO2中所有原子_____________(填“是”或“不是”)都滿足8電子結構。上圖所示電解法制得的產物中雜質氣體B能使石蕊試液顯藍色,除去雜質氣體可選用_________
A.飽和食鹽水 B.堿石灰 C.濃硫酸 D.蒸餾水
(2) 穩定性二氧化氯是為推廣二氧化氯而開發的新型產品,下列說法正確的是_________
A.二氧化氯可廣泛用于工業和飲用水處理
B.穩定性二氧化氯的出現大大增加了二氧化氯的使用范圍
C.在工作區和成品儲藏室內,要有通風裝置和監測及警報裝置
(3) 歐洲國家主要采用氯酸鈉氧化濃鹽酸制備。化學反應方程式為______________________。
(4) 我國廣泛采用經干燥空氣稀釋的氯氣與固體亞氯酸鈉(NaClO2)反應制備,化學方程式是 __________________,此法相比歐洲方法的優點是______________________。
(5) 科學家又研究出了一種新的制備方法,利用硫酸酸化的草酸(H2C2O4)溶液還原氯酸鈉,化學反應方程式為_____________________________。此法提高了生產及儲存、運輸的安全性,原因是 _________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】中學化學中幾種常見物質的轉化關系如下圖所示

將D溶液滴入沸水中可得到以F為分散質的紅褐色膠體.請回答下列問題:
(1)紅褐色膠體中F粒子直徑大小的范圍:________.
(2)A、B、H的化學式:A__________、B__________、 H________.
(3)①H2O2分子的電子式為______________。
②寫出C的酸性溶液與雙氧水反應的離子方程式: _______________________。
(4)寫出鑒定E中陽離子的實驗方法和現象:_______________________。
(5)在C溶液中加入與C等物質的量的Na 2 O 2 ,恰好使C轉化為F,寫出該反應的離子方程式:____________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用如右圖所示實驗裝置(夾持儀器已略去)探究銅絲與過量濃硫酸的反應。下列實驗不合理的是( )
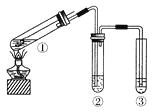
A. 上下移動①中銅絲可控制SO2的量
B. ②中選用品紅溶液驗證SO2的生成
C. ③中選用NaOH溶液吸收多余的SO2
D. 為確認CuSO4生成,向①中加水,觀察顏色
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com