
【題目】過氧化鈣(CaO2·8H2O)是一種在水產養殖中廣泛使用的供氧劑。
(1)Ca(OH)2懸濁液與H2O2溶液反應可制備CaO2·8H2O。
Ca(OH)2+H2O2+6 H2O===CaO2·8H2O
反應時通常加入過量的Ca(OH)2,其目的是_____________。
(2)向池塘水中加入一定量的CaO2·8H2O后,池塘水中濃度增加的離子有____________(填序號)。
A.Ca2+ B.H+ C.CO32– D.OH
(3)水中溶解氧的測定方法如下:向一定量水樣中加入適量MnSO4和堿性KI溶液,生成MnO(OH)2沉淀,密封靜置;加入適量稀H2SO4,待MnO(OH)2與I完全反應生成Mn2+和I2后,以淀粉作指示劑,用Na2S2O3標準溶液滴定至終點,測定過程中物質的轉化關系如下:
![]()
①寫出O2將Mn2+氧化成MnO(OH)2的離子方程式:_____________。
②取加過一定量CaO2·8H2O的池塘水樣100.00 mL,按上述方法測定水中溶解氧量,消耗0.01000 mol·L1 Na2S2O3標準溶液13.50 mL。計算該水樣中的溶解氧(以mg·L1表示),寫出計算過程。
【答案】(1)提高H2O2的利用率 (2)AD (3)①O2+2Mn2++4OH-===MnO(OH)2↓
②在100.00 mL水樣中
I2+2S2O32-===2I-+S4O62-
n(I2)=![]()
=![]()
=6.750×10-5 mol
n[MnO(OH)2]= n(I2)= 6.750×10-5 mol
n(O2)=![]() n[MnO(OH)2]=
n[MnO(OH)2]=![]() ×6.750×10-5mol=3.375×10-5 mol
×6.750×10-5mol=3.375×10-5 mol
水中溶解氧=![]() =10.80 mg/L
=10.80 mg/L
【解析】
試題分析:(1)根據反應的化學方程式可知反應時加入過量的Ca(OH)2可以提高H2O2的利用率。
(2)過氧化鈣與水反應生成氫氧化鈣、氧氣和水,因此向池塘水中加入一定量的CaO2·8H2O后,池塘水中濃度增加的離子有鈣離子和氫氧根離子,答案選AD。
(3)①O2將Mn2+氧化成MnO(OH)2中氧氣是氧化劑,1個O2分子得到4個電子,Mn元素的化合價從+2價升高到+4價,1個Mn2+失去2個電子,所以根據電子得失守恒以及原子守恒可知反應的離子方程式為O2+2Mn2++4OH-===MnO(OH)2↓。
②根據轉化關系圖,獲得各物質之間的量的關系,由此進行計算。


 云南師大附小一線名師提優作業系列答案
云南師大附小一線名師提優作業系列答案科目:高中化學 來源: 題型:
【題目】某研究性學習小組設計了一組實驗驗證元素周期律。
(Ⅰ)甲同學在a、b、c三只燒杯里分別加入50 mL水,再分別滴加幾滴酚酞溶液,依次加入大小相近的鋰、鈉、鉀塊,觀察現象。
甲同學設計實驗的目的是 , 燒杯 (填字母)中的反應最劇烈。
(Ⅱ)乙同學設計實驗驗證非金屬元素的非金屬性越強,對應的最高價含氧酸的酸性就越強。他設計了下圖裝置以驗證氮、碳、硅元素的非金屬性強弱。
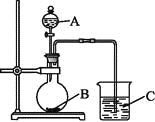
乙同學設計的實驗可直接證明三種酸的酸性強弱,已知A是強酸,常溫下可與銅反應;B是塊狀固體;打開分液漏斗的活塞后,C中可觀察到有白色沉淀生成。
(1)寫出所選用物質的化學式:A: ;B: ; C: 。
(2)寫出燒杯中發生反應的離子方程式:
(3)該裝置存在著某個缺陷,改進的方法是
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應:
①氫氧化鈉與硫酸,②一氧化碳與氧氣,③八水合氫氧化鋇與氯化銨,④金屬銅與硝酸銀。
(1)屬于復分解反應的放熱反應的是____________________________。(用序號填空)
(2)屬于吸熱反應的是_____________________________________________。(用序號填空)
(3)能設計成原電池的反應是_______________________________________。(用序號填空)
(4)能設計成燃料電池的反應是_____________________________________。(用序號填空)
(5) 寫出③發生反應的化學方程式___________________________________。
寫出④發生反應的離子方程式___________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】隨著人類對溫室效應和資源短缺等問題的重視,如何降低大氣中CO2的含量及有效地開發利用CO2,引起了各國的普遍重視。目前工業上有一種方法是用CO2來生產燃料甲醇。為探究反應原理,現進行如下實驗,在體積為1 L的密閉容器中,充入lmol CO2和3mol H2,一定條件下發生反應:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H = —49.0kJ/mo1.測得CO2和CH3OH(g)的濃度隨時間變化如圖所示。
CH3OH(g)+H2O(g) △H = —49.0kJ/mo1.測得CO2和CH3OH(g)的濃度隨時間變化如圖所示。
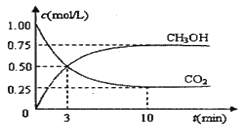
(1)從反應開始到平衡,氫氣的平均反應速率v(H2)= mol/(L·min)
(2)該反應的平衡常數為 。
(3)下列措施中能使n(CH3OH)/n(CO2)增大的是 。
A.升高溫度 B.充入He(g),使體系壓強增大
C.將H2O(g)從體系中分離 D.再充入lmol CO2和3mol H2
(4)已知在常溫常壓下:
①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(g) △H= —1275.6kJ/mol
②H2O(g)=H2O(1) △H= —44.0kJ/mol
則甲醇的燃燒熱化學方程式為: ;
(5)如果燃燒甲醇會造成大量化學能損失,如果以甲醇和空氣為原料,以氫氧化鈉為電解質溶液設計成原電池將有很多優點,請書寫出該電池的負極反應:___________________
(6)常溫下,某水溶液M中存在的離子有:Na+、A—、H+、OH—。若該溶液M由 pH=3的HA溶液![]() mL與pH=11的NaOH溶液
mL與pH=11的NaOH溶液![]() mL混合反應而得,則下列說法中正確的是 __。
mL混合反應而得,則下列說法中正確的是 __。
A.若溶液M呈中性,則溶液M中c(H+)+c(OH—)=2×10—7mol·L-1
B.若V1=V2,則溶液M的pH一定等于7
C.若溶液M呈酸性,則V1一定大于V2
D.若溶液M呈堿性,則V1一定小于V2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖只表示出與反應有關的一種反應物或生成物(無關物質已略去),其中A、C為無色氣體,請填寫下列空白。
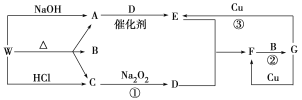
(1)化合物W可能是________或__________(填化學式),C的結構式是________,
(2)D的組成元素在周期表中的位置是__________。
(3)反應③的離子方程式:________________________。
(4)已知在催化劑作用下,E與CO反應生成參與大氣生態循環的無毒物質,請寫出該反應的化學方程式 。
(5)在反應②中,發生還原反應和氧化反應的物質的質量之比為__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ已知NiXO晶體晶胞結構為NaCl型(如圖),由于晶體缺陷,x值小于1。測知NiXO晶體x=0.88,晶胞邊長為4.28×10-10m 求:(已知:![]() =1.4)
=1.4)
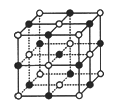
(1)晶胞中兩個Ni原子之間的最短距離___________m(精確至0.01)。
(2)與O2-距離最近且等距離的Ni離子圍成的幾何體形狀___ ____。
(3)晶體中的Ni分別為Ni2﹢、Ni3﹢,求此晶體的化學式_________。
(4)已知,NiO晶體熔點大于NaCl,主要原因是______________________________。
Ⅱ金晶體是面心立方最密堆積,立方體的每個面上5個金原子緊密堆砌(如圖,其余各面省略),金原子半徑為A cm,求:
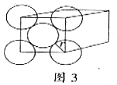
(1)金的密度為___________![]() 。(用帶A計算式表示)
。(用帶A計算式表示)
(2)金原子空間占有率為___________。(用帶A計算式表示)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】金屬(M)–空氣電池(如圖)具有原料易得、能量密度高等優點,有望成為新能源汽車和移動設備的電源。該類電池放電的總反應方程式為:4M+nO2+2nH2O=4M(OH) n。已知:電池的“理論比能量”指單位質量的電極材料理論上能釋放出的最大電能。下列說法不正確的是

A. 采用多孔電極的目的是提高電極與電解質溶液的接觸面積,并有利于氧氣擴散至電極表面
B. 比較Mg、Al、Zn三種金屬–空氣電池,Al–空氣電池的理論比能量最高
C. M–空氣電池放電過程的正極反應式:4Mn++nO2+2nH2O+4ne–=4M(OH)n
D. 在Mg–空氣電池中,為防止負極區沉積Mg(OH)2,宜采用中性電解質及陽離子交換膜
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】優質碳酸鈣是制造牙膏的原料之一,某同學利用等質量同種石灰石制優質碳酸鈣。設計如圖所示的甲、乙兩條路線(假設雜質不參與反應,每一步反應完全)。下列評價正確的是
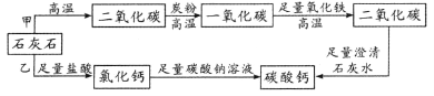
A.甲、乙方案制得碳酸鈣質量相等,甲方案反應條件苛刻、過程復雜
B.甲、乙兩方案制得碳酸鈣質量相等,乙方案操作簡單、安全可靠
C.甲方案制得碳酸鈣是乙方案的2倍,溫度高、反應速率快,比乙方案好
D.甲方案制得碳酸鈣是乙方案的2倍,但乙的操作簡單,反應環節少,綜合起來比甲方案好
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com