
【題目】按要求寫出下列化學方程式或離子方程式:
(1)PbO2與濃鹽酸共熱生成黃綠色氣體,反應的化學方程式為___。
(2)KClO3可用于實驗室制O2,若不加催化劑,400℃時分解只生成兩種鹽,其中一種是無氧酸鹽,另一種鹽的陰陽離子個數比為1:1。寫出該反應的化學方程式:___。
(3)Na2S2O3還原性較強,在溶液中易被Cl2氧化成SO42-,常用作脫氯劑,該反應的離子方程式為___。
【答案】PbO2+4HCl(濃)![]() PbCl2+Cl2↑+2H2O 4KClO3
PbCl2+Cl2↑+2H2O 4KClO3![]() KCl+3KClO4 S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+
KCl+3KClO4 S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+
【解析】
(1)PbO2與濃鹽酸共熱生成的黃綠色氣體為Cl2,同時有PbCl2和水;
(2)KClO3可用于實驗室制O2,若不加催化劑,400℃時分解只生成兩種鹽,一種是無氧酸鹽,應為KCl,另一種鹽的陰陽離子個數比為1:1,由電子轉移守恒可知該鹽為KClO4;
(3)Na2S2O3還原性較強,在溶液中易被Cl2氧化成SO42-,氯氣被還原生成氯離子。
(1)PbO2與濃鹽酸共熱生成的黃綠色氣體為Cl2,發生反應的化學方程式為PbO2+4HCl(濃)![]() PbCl2+Cl2↑+2H2O;
PbCl2+Cl2↑+2H2O;
(2)KClO3可用于實驗室制O2,若不加催化劑,400℃時分解只生成兩種鹽,一種是無氧酸鹽,應為KCl,另一種鹽的陰陽離子個數比為1:1,由電子轉移守恒可知該鹽為KClO4,反應方程式為:4KClO3![]() KCl+3KClO4;
KCl+3KClO4;
(3)Na2S2O3還原性較強,在溶液中易被Cl2氧化成SO42-,氯氣被還原生成氯離子,離子方程式為S2O32-+4Cl2+5H2O═2SO42-+8Cl-+10H+。


 快捷英語周周練系列答案
快捷英語周周練系列答案科目:高中化學 來源: 題型:
【題目】化工生產與人類進步緊密相聯。下列有關說法不正確的是
A. 空氣吹出法提取海水中溴通常使用SO2作還原劑
B. 侯氏制堿法工藝流程中利用了物質溶解度的差異
C. 合成氨采用高溫、高壓和催化劑主要是提高氫氣平衡轉化率
D. 工業用乙烯直接氧化法制環氧乙烷體現綠色化學和原子經濟
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A.1molO2與金屬Na反應,O2一定得到4NA個電子
B.18gNH4+中所含的電子數為11NA
C.1molFe與足量的Cl2反應,轉移的電子數為2NA
D.1molCl2與足量的Fe反應,轉移的電子數為2NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】請按要求完成下列各題。
(1)將2molL-1Al2(SO4)3和0.2molL-1H2SO4溶液等體積混合(設混合溶液體積等于兩溶液體積之和),計算混合液中c(SO42-)=___molL-1.若用容量瓶以質量分數為98%、密度為1.84g/cm3的濃硫酸,配制480mL濃度成0.2molL-1稀硫酸,計算需要量取___mL的濃硫酸。(讀到小數點后一位)
(2)在標準狀況下,由CO和CO2組成的混合氣體6.72L,質量為12g。此混合物中CO和CO2分子數目之比是___,混合氣體的平均摩爾質量是___。
(3)還原鐵粉與高溫水蒸氣反應的化學方程式:___。
(4)除去Mg粉中的Al粉的試劑是___,反應的離子方程式為:___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】銅是人類發現最早并廣泛使用的一種金屬。回答下列問題:
(1)實驗室使用稀硫酸和H2O2溶解銅片,該反應的化學方程式為___。
(2)電子工業使用FeCl3溶液刻蝕印刷電路板銅箔,寫出該過程的離子方程式___,配制的FeCl3溶液應保持酸性,原因是__。
(3)溶液中Cu2+的濃度可采用碘量法測得:
①2Cu2++5I-=2CuI↓+I3-
②I3-+2S2O32-=S4O62-+3I-
現取20.00mL含Cu2+的溶液,加入足量的KI充分反應后,用0.1000mol·L-1的Na2S2O3標準溶液滴定至終點,消耗Na2S2O3溶液25.00mL,此溶液中Cu2+的濃度為__mol·L-1。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將鋁浸入![]() 溶液中,取出晾干,置于空氣中,表面會生成毛狀物質(俗稱毛刷),反應為4Al(Hg)+3O2+2xH2O→2(Al2O3xH2O),下列說法正確的是( )
溶液中,取出晾干,置于空氣中,表面會生成毛狀物質(俗稱毛刷),反應為4Al(Hg)+3O2+2xH2O→2(Al2O3xH2O),下列說法正確的是( )
A.![]() 發生氧化反應,
發生氧化反應,![]() 是氧化劑
是氧化劑
B.![]() 既是氧化產物也是還原產物
既是氧化產物也是還原產物
C.該反應屬于置換反應
D.當![]() 鋁參加反應,轉移電子數為
鋁參加反應,轉移電子數為![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
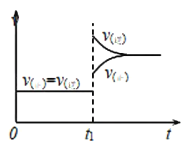
【題目】對于反應![]() ,減小壓強,平衡向______(填“正反應”或“逆反應”)方向移動,平衡混合氣體的平均相對分子質量在平衡移動時______(填“是”或“否”)發生改變,其原因是____________;下圖是反應速率與時間的關系圖,
,減小壓強,平衡向______(填“正反應”或“逆反應”)方向移動,平衡混合氣體的平均相對分子質量在平衡移動時______(填“是”或“否”)發生改變,其原因是____________;下圖是反應速率與時間的關系圖,![]() 時刻引起正、逆反應速率變化的原因可能是____________(寫一條合理原因)。
時刻引起正、逆反應速率變化的原因可能是____________(寫一條合理原因)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】保水劑是一種強吸水樹脂,能在短時間內吸收自身重量幾百倍至上千倍的水分。聚丙烯酸鈉就是一種高吸水性樹脂。下面是丙烯合成聚丙烯酸鈉的化工流程:

(1)上述反應中屬于加成反應的有____________,反應⑧的反應類型為____________;
(2)若(1)的反應條件為通過溴的四氯化碳溶液,請寫出A的結構簡式____________;D中官能團名稱是____________。
(3)請寫出C→D的化學反應方程式__________________。
(4)![]() 是
是![]() 的同系物,式量比
的同系物,式量比![]() 大14,寫出2種符合下列要求的
大14,寫出2種符合下列要求的![]() 的同分異構體:①鏈狀分子;②與新制氫氧化銅在加熱條件下反應生成磚紅色沉淀;③與
的同分異構體:①鏈狀分子;②與新制氫氧化銅在加熱條件下反應生成磚紅色沉淀;③與![]() 溶液混合后滴入酚酞,加熱,溶液顏色變淺。__________、___________
溶液混合后滴入酚酞,加熱,溶液顏色變淺。__________、___________
(5)檢驗反應(4)是否全部轉化的實驗方案__________________。
(6)丙酮(![]() )是一種常用的化工試劑,請設計一條由丙烯制備丙酮的合成路線。(合成路線常用的表示方式為:
)是一種常用的化工試劑,請設計一條由丙烯制備丙酮的合成路線。(合成路線常用的表示方式為:![]() )
)
____________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硼和氮的單質及一些化合物在工農業生產等領域有重要應用。回答下列問題:
(1)N原子核外有___ 種不同運動狀態的電子。基態N原子中,能量最高的電子所占據的原子軌道的形狀為____________________________。
(2)經測定發現,N2O5固體由NO2+ 和NO3-兩種離子組成,該固體中N原子雜化類型為_________;與NO2+互為等電子體的微粒有_______(寫出一種)。
(3)HF和HI電離出H+較難的是________(填化學式,下同)。銨鹽大多不穩定,請預測NH4F、NH4I中,較易分解的是________。
(4)第二周期中,第一電離能介于B元素和N元素間的元素為_____(填“元素符號”)。
(5)晶體硼有多種變體,但其基本結構單元都是由硼原子組成的正二十面體( 見圖I),每個頂點為一個硼原子,每個三角形均為等邊三角形。則每一個此基本結構單元由_______個硼原子構成;若該結構單元中有2 個原子為10B(其余為11B),那么該結構單元有_____種不同類型。
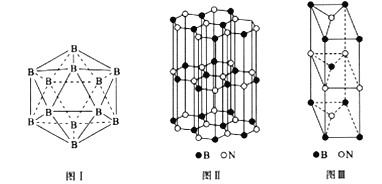
(6)硼和氮構成的一種氮化硼晶體的結構與石墨晶體結構相類似,B、N原子相互交替排列(見圖II),其晶胞結構如圖III所示。該晶胞有_____個B和_____個N。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com