

(1)B點溶液呈中性,有人據此認為,在B點時NaOH與CH3COOH恰好完全反應,這種看法是否正確?___________(選填“是”或“否”)。若不正確,則二者恰好完全反應的點是在AB區間還是BD區間內?___________區間(若正確,此問不答)。
(2)關于該滴定實驗,從下列選項中選出最恰當的一項___________。(選填字母)

| 錐形瓶中溶液 | 滴定管中溶液 | 選用指示劑 | 選用滴定管 |
A | 堿 | 酸 | 石蕊 | (乙) |
B | 酸 | 堿 | 甲基橙 | (甲) |
C | 堿 | 酸 | 酚酞 | (甲) |
D | 酸 | 堿 | 酚酞 | (乙) |
(3)AB區間,c(OH-)>c(H+),則c(OH-)與c(CH3COO-)大小關系是________。
A.c(OH-)一定大于c(CH3COO-) B.c(OH-)一定小于c(CH3COO-)
C.c(OH-)一定等于c(CH3COO-) D.c(OH-)大于、小于或等于c(CH3COO-)
(4)在D點時,溶液中c(CH3COO-)+c(CH3COOH)___________2c(Na+)。(填“>”“<”或“=”)
Ⅱ.t ℃時,某稀硫酸溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=13:
(5)該溫度下水的離子積常數KW的數值為___________。
(6)該溫度下(t ℃),將100 mL 0.1 mol·L-1的稀硫酸溶液與100 mL 0.4 mol·L-1的NaOH溶液混合后(溶液體積變化忽略不計),溶液的pH=___________。
(1)否 AB (2)C (3)D (4)= (5)10-13或1.0×10-13 6)12
解析:Ⅰ.應從醋酸與氫氧化鈉反應生成的醋酸鈉性質角度分析。醋酸鈉水解導致其溶液呈堿性,問題(1)中的說法錯誤。因向氫氧化鈉溶液中滴加醋酸,故滴定管為酸式,錐形瓶中是氫氧化鈉溶液,所加試劑為酚酞或甲基橙溶液,故選C。在AB區間中存在c(H+)+c(Na+)=c(OH-) +c(CH3COO-),又知c(H+)<c(OH-),故c(OH-)與c(CH3COO-)無法比較,選D。當加入醋酸為25 mL時,即n(CH3COOH)=2n(NaOH),故溶液中存在c(CH3COOH)+c(CH3COO-) =
Ⅱ.根據硫酸溶液中c(H+)、c(OH-)可得KW=10-13 (mol·L-1)2。問題(6)則需判斷出氫氧化鈉過量導致混合溶液呈堿性再計算。


科目:高中化學 來源:浙江省杭州高級中學2012屆高三第三次月考化學試題 題型:022
下圖為常溫下向25 mL 0.1 mol·L-1 MOH溶液中逐滴滴加0.2 mol·L-1HA溶液過程中溶液pH的變化曲線.

回答下列問題:
(1)上圖能確定MOH為________(“強”或“弱”)堿,理由是________.
(2)上圖能確定HA為________(“強”或“弱”)酸,理由是________.
(3)在D點時,溶液中c(A-)+c(HA)________2c(M+).(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化學 來源: 題型:
(1)經測定,A2D2的水溶液呈弱酸性。請寫出第一步的電離方程式。
(2)用甲和單質D2可設計呈燃料電池,若電解質溶液為濃KOH溶液,則正極的電極反應式為______________________________。
(3)
(4)單質F與E的最高價氧化物的水化物的溶液反應的離子方程式是_______________。
(5)常溫下向25 mL 0.1 mol·L-1丙溶液中逐滴滴加0.1 mol·L-1丁溶液,滴加過程中混合溶液pH的變化曲線如下圖所示:

①圖中m點由水電離出的OH-的物質的量濃度為___________________;
②p點時,丙溶液和丁溶液恰好完全反應,則p點溶液中各種離子濃度由大到小的順序為_____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
(15分)PCl3可用于半導體生產的外延、擴散工序。有關物質的部分性質如下:
(一)制備
下圖是實驗室制備PCI3的裝置(部分儀器已省略)
(1)儀器乙的名稱 ;
(2)實驗室制備Cl2的離子方程式: ;
(3)堿石灰的作用是 , ;
(4)向儀器甲中通人干燥Cl2之前,應先通人一段時間的CO2,其目的是 。
(二)提純
粗產品中常含有POCl3、PCl5等。加入黃磷加熱除去PCl5后,通過____(填實驗操作名稱),即可得到PCl3的純品。
(三)分析
測定產品中PCl3純度的方法如下:迅速稱取m,g產品,水解完全后配成500mL溶液,取出25.00mL加入過量的c1mol·L-lV1mL碘溶液,充分反應后再用c2mol·L-1Na2S2O3溶液滴定過量的碘,終點時消耗V2mLNa2S2O3溶液。
已知:H3PO3+H2O+I2=H3PO4+2HI;I2+2Na2S2O3=2NaI+Na2S4O6;假設測定過程中沒有其他反應。
根據上述數據,該產品中PCl3的質量分數為 (用含字母的代數式表示、不必化簡)
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
(一)(6分) 將2.5g碳酸鈉、碳酸氫鈉和氫氧化鈉固體混合物完全溶解于水,制成稀溶液,然后向該溶液中逐滴加入1mol/L的鹽酸,所加入鹽酸的體積與產生CO2的體積(標準狀況)關系如下圖所示:
(1)寫出OA段所發生反應的離子方程式
(2)當加入35mL鹽酸時,產生二氧化碳的體積為 mL(標準狀況)
(3)原混合物中Na2CO3的質量分數為 。
(二).氨是重要的氮肥,是產量最大的化工產品之一。課本里介紹的合成氨技術叫哈伯法,是德國化學家哈伯在1905年發明的,其合成原理為:N2(g) + 3H2(g)![]() 2NH3(g);
2NH3(g);
△H=―92.4 kJ/mol,他因此獲得了1918年度諾貝爾化學獎。試回答下列問題:
⑴ 下列方法不適合實驗室制取氨氣的是 (填序號)。
A.向生石灰中滴入濃氨水 B.加熱濃氨水
C.直接用氫氣和氮氣合成 D.向飽和氯化銨溶液中滴入濃氫氧化鈉溶液
⑵ 合成氨工業中采取的下列措施可用勒夏特列原理解釋的是 (填序號)。
A.采用較高壓強(20 M Pa~50 M Pa)
B.采用500℃的高溫
C.用鐵觸媒作催化劑
D.將生成的氨液化并及時從體系中分離出來,未反應的N2和H2循環到合成塔中
(3) 用數字化信息系統DIS(如下圖Ⅰ所示:它由傳感器、數據采集器和計算機組成)可以測定上述氨水的濃度。用酸式滴定管準確量取0.5000 mol/L醋酸溶液25.00 mL于燒杯中,以該種氨水進行滴定,計算機屏幕上顯示出溶液導電能力隨氨水體積變化的曲線如下圖Ⅱ所示。


圖Ⅰ 圖Ⅱ
① 用滴定管盛氨水前,滴定管要用 潤洗2~3遍,
② 試計算該種氨水的濃度: 。
③ 下列情況下,會導致實驗結果c(NH3·H2O)偏低的是 。
A.滴定結束時仰視讀數
B.量取25.00 mL醋酸溶液時,未用所盛溶液潤洗滴定管
C.滴定時,因不慎將氨水滴在燒杯外
(4) 1998年希臘亞里士多德大學的Marnellos和Stoukides采用高質子導電性的SCY陶瓷(能傳遞H+),實現了高溫常壓下高轉化率的電化學合成氨。其實驗裝置如下圖。

正極的電極反應式為: 。
查看答案和解析>>
科目:高中化學 來源:2010-2011學年河北省高三下學期第一次調研考試(理綜)化學部分 題型:填空題
(一)(6分) 將2.5g碳酸鈉、碳酸氫鈉和氫氧化鈉固體混合物完全溶解于水,制成稀溶液,然后向該溶液中逐滴加入1mol/L的鹽酸,所加入鹽酸的體積與產生CO2的體積(標準狀況)關系如下圖所示:
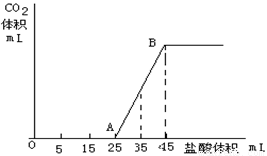
(1)寫出OA段所發生反應的離子方程式
(2)當加入35mL鹽酸時,產生二氧化碳的體積為 mL(標準狀況)
(3)原混合物中Na2CO3的質量分數為 。
(二).氨是重要的氮肥,是產量最大的化工產品之一。課本里介紹的合成氨技術叫哈伯法,是德國化學家哈伯在1905年發明的,其合成原理為:N2(g) + 3H2(g) 2NH3(g);
2NH3(g);
△H=―92.4 kJ/mol,他因此獲得了1918年度諾貝爾化學獎。試回答下列問題:
⑴ 下列方法不適合實驗室制取氨氣的是 (填序號)。
A.向生石灰中滴入濃氨水 B.加熱濃氨水
C.直接用氫氣和氮氣合成 D.向飽和氯化銨溶液中滴入濃氫氧化鈉溶液
⑵ 合成氨工業中采取的下列措施可用勒夏特列原理解釋的是 (填序號)。
A.采用較高壓強(20 M Pa~50 M Pa)
B.采用500℃的高溫
C.用鐵觸媒作催化劑
D.將生成的氨液化并及時從體系中分離出來,未反應的N2和H2循環到合成塔中
(3) 用數字化信息系統DIS(如下圖Ⅰ所示:它由傳感器、數據采集器和計算機組成)可以測定上述氨水的濃度。用酸式滴定管準確量取0.5000 mol/L醋酸溶液25.00 mL于燒杯中,以該種氨水進行滴定,計算機屏幕上顯示出溶液導電能力隨氨水體積變化的曲線如下圖Ⅱ所示。
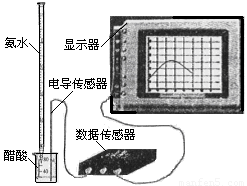
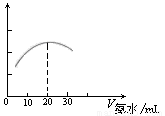
圖Ⅰ 圖Ⅱ
① 用滴定管盛氨水前,滴定管要用 潤洗2~3遍,
② 試計算該種氨水的濃度: 。
③ 下列情況下,會導致實驗結果c(NH3·H2O)偏低的是 。
A.滴定結束時仰視讀數
B.量取25.00 mL醋酸溶液時,未用所盛溶液潤洗滴定管
C.滴定時,因不慎將氨水滴在燒杯外
(4) 1998年希臘亞里士多德大學的Marnellos和Stoukides采用高質子導電性的SCY陶瓷(能傳遞H+),實現了高溫常壓下高轉化率的電化學合成氨。其實驗裝置如下圖。
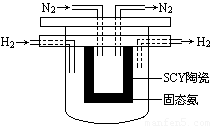
正極的電極反應式為: 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com