
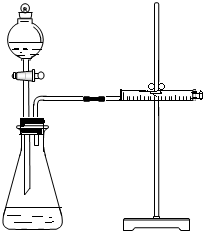
 影響化學反應速率的因素很多,某學校化學小組用實驗的方法進行探究.他們只利用Cu、Fe、Mg和不同濃度的硫酸(0.5mol/L、2mol/L、18.4mol/L),設計實驗方案來探究影響化學反應速率的因素.甲同學的實驗報告如下表:
影響化學反應速率的因素很多,某學校化學小組用實驗的方法進行探究.他們只利用Cu、Fe、Mg和不同濃度的硫酸(0.5mol/L、2mol/L、18.4mol/L),設計實驗方案來探究影響化學反應速率的因素.甲同學的實驗報告如下表:| 實驗步驟 | 現象 | 結論 |
| ①分別取等體積2mol/L的硫酸于試管中 ② | Mg產生氣泡速率快于Fe,Cu無明顯變化 | 金屬性質越活潑,反應速率越快 |
分析 (1)根據表中數據可知,硫酸的濃度相同,不同金屬的規格相同,說明實驗目的是探究反應物本身對反應速率的影響;影響反應速率的還有溫度,所以應該使反應溫度相同;
(2)根據圖示裝置及選取的試劑可知,實驗目的是通過測定反應生成氫氣快慢進行判斷濃度對反應速率的影響;
(3)根據v=$\frac{△V}{△t}$確定測定量;
(4)金屬和酸反應生成氫氣.
解答 解:(1)根據表中的信息得出該同學的實驗目的是研究反應物本身的性質對反應速率的關系對反應速率的影響,根據表中數據可知,硫酸的濃度相同,不同金屬的規格應相同,故答案為:分別投入大小、形狀相同的Al、Fe、Mg;
(2)根據表中的信息得出該同學的實驗目的是研究反應物本身的性質對反應速率的關系對反應速率的影響,溫度對化學反應速率的影響較大,故根據控制變量法,要得出正確的實驗結論,還需控制的實驗條件是保持溫度相同,
故答案為:探究反應物本身的性質對反應速率的影響;溫度相同;
(3)乙同學為了更精確地研究濃度對反應速率的影響,根據v=$\frac{△V}{△t}$知應該測定的實驗數據是測定一定時間產生氣體的體積或測定產生一定體積的氣體所需時間,
故答案為:測定同一金屬與濃度不同但體積相同的硫酸產生一定體積的氣體所需要的時間于(或在一定時間內產生氣體的體積);
(4)乙同學為了更精確地研究濃度對反應速率的影響,利用如圖1裝置進行定量實驗,圖1中藥品是金屬和酸,濃硫酸和鐵發生鈍化現象而影響判斷,所以完成該實驗應選用的實驗藥品是Mg(或Fe)和 0.5mol/L、2mol/L的硫酸,故答案為:Mg(或Fe)和 0.5mol/L、2mol/L的硫酸.
點評 本題考查了探究影響化學反應速率的因素,注意做對比實驗時只能改變一個條件,其它條件必須相同,否則無法得出正確結論.


科目:高中化學 來源: 題型:選擇題
| A. | 反應停止了 | B. | 正反應速率與逆反應速率相等 | ||
| C. | 反應物和生成物濃度相等 | D. | 正反應速率與逆反應速率均為零 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 在NaCl晶體中,距Na+最近的Cl-有6個 | |
| B. | 在NaCl晶體中,每個晶胞實際擁有4個Na+、4個Cl- | |
| C. | 在金剛石晶體中,碳原子與碳碳鍵的數目比為1:4 | |
| D. | 在金剛石晶體中,最小環是由6個碳原子構成 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
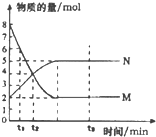
| A. | 反應式中a:b=2:5 | |
| B. | 0-t1物質M的濃度c(M)減少了1mol•L-1 | |
| C. | t2時,c(M)=c(N)=4mol•L-1,反應一定達到平衡狀態 | |
| D. | t3時,c(M)不再變化,正反應速率小于逆反應速率 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NaHS水解:HS-+H2O?S2-+H3O+ | |
| B. | 向硫酸鐵溶液中加入鐵:Fe3++Fe═2Fe2+ | |
| C. | 在鐵上鍍銅陽極反應為:Cu2++2e-═Cu | |
| D. | 氯化銅水解:Cu2++2H2O?Cu(OH)2+2H+ |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| 化學式 | 顏色 | Ksp |
| AgCl | 白色 | 2.0×10-10 |
| AgBr | 淺黃色 | 5.4×10-13 |
| AgI | 黃色 | 8.3×10-17 |
| Ag2S | 黑色 | 2.0×10-48 |
| Ag2CrO4 | 紅色 | 2.0×10-12 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 陽離子 | Fe3+ | Al3+ | Mg2+ |
| 開始沉淀時的pH | 1.9 | 3.7 | 9.6 |
| 沉淀完全時的pH | 3.2 | 5.2 | 11.0 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
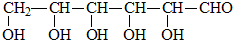 B.CH3CH2OH
B.CH3CH2OH 乳酸 D.
乳酸 D.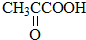 丙酮酸
丙酮酸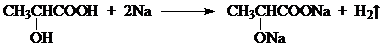 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com