
| A. | △H>0表示放熱反應,△H<0表示吸熱反應 | |
| B. | 反應產物的總焓大于反應物的總焓時,△H>0 | |
| C. | △H的大小與熱化學方程式中的各物質的化學計量數無關 | |
| D. | 在化學反應中,發生物質變化的同時不一定發生能量變化 |
分析 A、放熱反應的焓變小于0;
B、反應物總能量高于生成物時,反應放熱;
C、△H的數值與化學計量數對應,隨化學計量數的改變而改變;
D、化學反應過程就是舊化學鍵斷裂新化學鍵形成過程,斷裂化學鍵需吸收能量,形成化學鍵會釋放能量.
解答 解:A、△H=Q(生成物的能量和)-Q(反應物的能量和),反應物能量高時△H<0反應放熱,反之△H>0反應吸熱,故A錯誤;
B、△H=Q(生成物的能量和)-Q(反應物的能量和),所以△H>0時,反應產物的總焓大于反應物的總焓,故B正確;
C、△H的數值與化學計量數對應,隨化學計量數的改變而改變,故C錯誤;
D、化學反應過程就是舊化學鍵斷裂新化學鍵形成過程,斷裂化學鍵需吸收能量,形成化學鍵會釋放能量,所以,任何化學反應一定有能量變化,故D錯誤;
故選B.
點評 本題考查化學反應中能量變化與化學鍵的關系,以及△H的求算,題目難度不大,注意△H=Q(生成物的能量和)-Q(反應物的能量和).


 數學奧賽暑假天天練南京大學出版社系列答案
數學奧賽暑假天天練南京大學出版社系列答案 南大教輔搶先起跑暑假銜接教程南京大學出版社系列答案
南大教輔搶先起跑暑假銜接教程南京大學出版社系列答案科目:高中化學 來源: 題型:解答題
| 實驗方案(不要求寫出具體操作過程) | 預期的實驗現象和結論 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 3:1 | B. | 1:3 | C. | 2:3 | D. | 3:2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 (1)CO是高爐煉鐵的主要反應物之一,發生的主要反應為:
(1)CO是高爐煉鐵的主要反應物之一,發生的主要反應為:| 溫度/℃ | 1 000 | 1 150 | 1 300 |
| 平衡常數 | 4.0 | 3.7 | 3.5 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
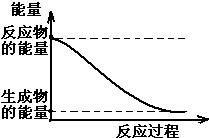 (1)20世紀30年代,Eyring和Pzer在碰撞理論的基礎上提出化學反應的過渡態理論:化學反應并不是通過簡單的碰撞就能完成的,而是在反應物到生成物的過程中經過一個高能量的過渡態.如圖是NO2和CO反應生成CO2和NO過程中的能量變化示意圖,說明這個反應是放熱.(填“吸熱”或“放熱”)反應,NO2和CO的總能量大于(填
(1)20世紀30年代,Eyring和Pzer在碰撞理論的基礎上提出化學反應的過渡態理論:化學反應并不是通過簡單的碰撞就能完成的,而是在反應物到生成物的過程中經過一個高能量的過渡態.如圖是NO2和CO反應生成CO2和NO過程中的能量變化示意圖,說明這個反應是放熱.(填“吸熱”或“放熱”)反應,NO2和CO的總能量大于(填查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 合成氨是人類科學技術上的一項重大突破,其反應原理為:
合成氨是人類科學技術上的一項重大突破,其反應原理為:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
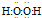 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | R位于元素周期表中的第VA族 | B. | R位于元素周期表中的第 VIIA族 | ||
| C. | RO3-中的R元素只能被還原 | D. | R2在常溫常壓下一定是氣體 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com