
分析 (1)燃燒熱是指1mol純凈物完全燃燒生成穩定的氧化物放出的熱量;中和反應反應熱:稀的強酸與強堿溶液反應生成1mol水放出熱量,以此解答該題;
(2)根據2.00g C2H2氣體完全燃燒生成液態水和CO2,放出99.6kJ的熱量,計算1molC2H2燃燒放出的熱量,結合化學方程式書寫熱化學方程式.注意物質的聚集狀態和反應熱的單位等問題;
(3)依據蓋斯定律D-B的CO(g)+$\frac{1}{2}$O2(g)=CO2(g)據此解答;
(4)依據中和熱測定步驟及量熱計構造解答.
解答 解:(1)A.2H2(g)+O2(g)═2H2O(l)△H1中氫氣的物質的量不是1mol,所以△H1不能表示燃燒熱,故A錯誤;
B.C(s)+$\frac{1}{2}$O2(g)═CO(g)△H2=-Q1kJ•mol-1,生成產物不是最穩定氧化物,所以△H2不能表示燃燒熱,故B錯誤;
C.CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H3,生成水為氣體,不是最穩定氧化物,所以△H3不能表示燃燒熱,故C錯誤;
D.C(s)+O2(g)═CO2(g)△H4=-Q2kJ•mol-1,碳的物質的量為1mol生成物二氧化碳為穩定氧化物,所以△H5能表示燃燒熱,故D正確;
E.NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H5,符合中和熱定義,△H5能表示中和反應反應熱,故E正確;
故答案為:△H4;△H5;
(2)C2H2氣體完全燃燒反應的化學方程式為:2C2H2+5O2$\stackrel{點燃}{→}$4CO2+2H2O,2.00g C2H2氣體n(C2H2)=$\frac{2g}{26g/mol}$=$\frac{1}{13}$mol,放出99.6kJ的熱量,則1molC2H2燃燒放出的熱量為:99.6kJ×13=1294.8KJ,則熱化學方程式為:2C2H2(g)+5O2=4CO2(g)+2H2O(l)△H2=-2589.6kJ•mol-1;
故答案為:2C2H2(g)+5O2=4CO2(g)+2H2O(l)△H2=-2589.6kJ•mol-1;
(3)依據蓋斯定律D-B的CO(g)+$\frac{1}{2}$O2(g)=CO2(g),所有反應的焓變為△H=(Q1-Q2)kJ•mol-1;
故答案為:(Q1-Q2)kJ•mol-1;
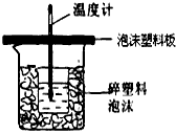
(4)反應E的△H6可以用如圖所示的裝置進行測量.實驗中直接測定的數據是溫度;
量熱計應帶環形玻璃攪拌棒;大燒杯上如不蓋硬紙板,導致熱量損失,所有求得的中和反應的反應熱的數值偏小;
故答案為:溫度;環形玻璃攪拌棒;偏小.
點評 本題考查了反應熱,明確燃燒熱、中和熱的概念是解題關鍵,注意蓋斯定律的計算方法,題目難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | BaCl2 Na2CO3 AgNO3 鹽酸 | B. | BaCl2 Na2CO3 鹽酸 AgNO3 | ||
| C. | Na2CO3 鹽酸 AgNO3 BaCl2 | D. | AgNO3 鹽酸 BaCl2 Na2CO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將兩種帶相反電荷的膠體混合,能發生聚沉 | |
| B. | 有化學鍵斷裂的變化一定是化學變化 | |
| C. | IA族元素形成的單質的熔點隨原子序數的遞增而降低 | |
| D. | 堿性氧化物一定是金屬氧化物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 過濾時,為了加快過濾速率,可用玻璃棒在過濾器內攪拌 | |
| B. | 用蒸發皿蒸發溶液時,邊加熱邊用玻璃棒攪拌,直到液體全部蒸干 | |
| C. | 萃取操作時,應選擇有機萃取劑,且萃取劑的密度必須比水大 | |
| D. | 分液操作時,分液漏斗中下層液體從下口放出,上層液體從上口倒出 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | “另一種反應物”一定只具有氧化性 | B. | “另一種反應物”一定具有還原性 | ||
| C. | 點燃時:2CuH+3Cl2═2CuCl2+2HCl | D. | CuH 既可做氧化劑也可做還原劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ;該物質溶于水后的溶液呈堿性(填“酸”、“堿”或“中”).
;該物質溶于水后的溶液呈堿性(填“酸”、“堿”或“中”). .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com