
 T℃時,在一個體積為2L的容器中,A氣體與B氣體反應生成C氣體,反應過程中A、B、C濃度變化如圖所示.
T℃時,在一個體積為2L的容器中,A氣體與B氣體反應生成C氣體,反應過程中A、B、C濃度變化如圖所示.分析 (1)根據圖知,隨著反應的進行,A、B的物質的量減小而C的物質的量增加,則A、B是反應物而C是生成物,達到平衡狀態時△n(A)=(2.4-1.6)mol=0.8mol、△n(B)=(1.6-1.2)mol=0.4mol、△n(C)=(0.4-0)mol=0.4mol,同一時間段內各物質物質的量變化量之比與其計量數之比相等,據此確定方程式;
(2)反應達到平衡狀態時,c(A)=$\frac{1.6mol}{2L}$=0.8mol/L、c(B)=$\frac{1.2mol}{2L}$=0.6mol/L、c(C)=$\frac{0.4mol}{2L}$=0.2mol/L,化學平衡常數K等于生成物濃度冪之積與反應物濃度冪之積之比;
(3)升高溫度,化學平衡向吸熱反應方向移動;
(4)0-4min內,A的平均反應速率=$\frac{\frac{△n(A)}{V}}{△t}$;
(5)達到平衡狀態時,B的轉化率=$\frac{0.4mol}{1.6mol}×100%$.
解答 解:(1)根據圖知,隨著反應的進行,A、B的物質的量減小而C的物質的量增加,則A、B是反應物而C是生成物,達到平衡狀態時△n(A)=(2.4-1.6)mol=0.8mol、△n(B)=(1.6-1.2)mol=0.4mol、△n(C)=(0.4-0)mol=0.4mol,同一時間段內各物質物質的量變化量之比與其計量數之比相等,所以A、B、C的計量數之比=0.8mol:0.4mol:0.4mol=2:1:1,所以該反應方程式為2A+B?C,
故答案為:2A+B?C;
(2)反應達到平衡狀態時,c(A)=$\frac{1.6mol}{2L}$=0.8mol/L、c(B)=$\frac{1.2mol}{2L}$=0.6mol/L、c(C)=$\frac{0.4mol}{2L}$=0.2mol/L,化學平衡常數K等于生成物濃度冪之積與反應物濃度冪之積之比,K=$\frac{0.2}{0.6×0.{8}^{2}}$=0.52,
故答案為:0.52;
(3)升高溫度,化學平衡常數減小,化學平衡逆向移動,化學平衡向吸熱反應方向移動,則正反應是放熱反應,故答案為:放;
(4)0-4min內,A的平均反應速率=$\frac{\frac{△n(A)}{V}}{△t}$=$\frac{\frac{(2.4-2.0)mol}{2L}}{4min}$=0.05mol/(L.min),故答案為:0.05mol/(L.min);
(5)達到平衡狀態時,B的轉化率=$\frac{0.4mol}{1.6mol}×100%$=25%,故答案為:25%.
點評 本題考查圖象分析,側重考查學生分析計算能力,涉及轉化率、反應速率、化學平衡常數的計算及外界條件對化學反應速率的影響,易錯點是平衡常數計算.


科目:高中化學 來源: 題型:選擇題
| A. | 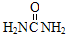 | B. | H2NCH2CH2NH2 | C. | (NH4)2CO3 | D. | Na2CO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原溶液中一定含有Fe3+離子,不含Fe2+ | |
| B. | 原溶液中一定含有Fe2+離子,不含Fe3+ | |
| C. | 溶液中的Fe2+離子被氯氣還原為Fe3+ | |
| D. | 溶液中同時含Fe2+或Fe3+離子 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 原子序數依次增大的前四周期五種元素X、Y、Z、M、W.已知X的一種單質是原子晶體,且是自然界中最堅硬的物質,Y原子最外層電子數是次外層的3倍,M與Y同主族,且M元素的單質為淡黃色;Z與M同周期,且Z元素與Y元素可以形成兩種化合物,其中一種化合物也為淡黃色;W是生活中使用最廣泛的金屬元素,且有+2和+3兩種常見化合價.據此回答:
原子序數依次增大的前四周期五種元素X、Y、Z、M、W.已知X的一種單質是原子晶體,且是自然界中最堅硬的物質,Y原子最外層電子數是次外層的3倍,M與Y同主族,且M元素的單質為淡黃色;Z與M同周期,且Z元素與Y元素可以形成兩種化合物,其中一種化合物也為淡黃色;W是生活中使用最廣泛的金屬元素,且有+2和+3兩種常見化合價.據此回答:查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,22.4L乙醇所含的分子數為NA | |
| B. | 1mol/LCaCl2溶液中含有的氯離子數目為2NA | |
| C. | 1 mol金屬鈉在足量氧氣中完全燃燒轉移的電子數為2NA | |
| D. | 28g N2中含有的原子數為2NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 實驗操作 | 現象 | 結論 | |
| A | 稀硫酸滴入碳酸鈉溶液中,將產生的氣體通入盛有硅酸鈉溶液的燒杯中 | 燒杯中產生白色膠狀沉淀 | 非金屬性:S>C>Si |
| B | 用鉑絲蘸取少量某溶液進行焰色反應 | 火焰呈黃色 | 該溶液一定是鈉鹽溶液 |
| C | 將飽和氯化鐵溶液滴入盛有沸水的燒杯中,繼續煮沸至溶液呈紅褐色,停止加熱,用激光筆照射燒杯中的液體 | 看到一條光亮的“通路” | 證明生成了氫氧化鐵沉淀 |
| D | 在分液漏斗中加入碘水后再加入CCl4,充分振蕩、靜置 | 分層,且上層溶液呈紫色 | CCl4可作為碘的萃取劑 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 1834年,德國科學家米希爾里希通過蒸餾苯甲酸和石灰的混合物,得到了魚法拉第所制液體相同的一種液體,并命名為苯.后來,法國化學家熱拉爾等人又確定了苯的分子式為C6H6.
1834年,德國科學家米希爾里希通過蒸餾苯甲酸和石灰的混合物,得到了魚法拉第所制液體相同的一種液體,并命名為苯.后來,法國化學家熱拉爾等人又確定了苯的分子式為C6H6.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com