
| 選用試劑(填序號) | 實驗現象 | |
| 方案1 | ||
| 方案2 |
分析 (2)Fe2+的顏色:淺綠色,Fe3+的顏色:棕黃色,溴水的顏色:橙黃色.根據題意在足量的氯化亞鐵溶液中加入l-2滴溴水,如果不發生氧化還原反應,溶液呈黃色是由溴水引起的,如果發生反應:2 Fe2++Br2═2Fe3++2Br-,生成Fe3+,溶液呈黃色是由Fe3+引起的.即可得出甲同學、乙同學的結論;
(3)乙同學的觀點認為氧化性:Fe3+<Br2,則會發生反應:2 Fe2++Br2═2 Fe3++2Br-,要設計方案進行實驗證明乙同學的觀點確實正確,考慮兩種思路.第一,溶液中不存在Br2,然后選擇合適試劑檢驗不存在Br2.第二,溶液中存在Fe3+,選擇合適試劑檢驗存在Fe3+,即可確定乙同學觀點正確;
(4)由氧化性Br2>Fe3+,則氯化亞鐵溶液中加入1~2滴溴水發生氧化還原反應生成Fe3+;
(5)①還原性強的離子先被氧化;
②根據電子守恒進行計算.
解答 解:(2)Fe2+的顏色:淺綠色,Fe3+的顏色:棕黃色,溴水的顏色:橙黃色.根據題意在足量的氯化亞鐵溶液中加入l-2滴溴水,若Fe3+氧化性強于Br2,則不發生氧化還原反應,溶液呈黃色是由加入溴水引起的;如果Br2氧化性強于Fe3+,則發生反應:2Fe2++Br2═2Fe3++2Br-,生成了Fe3+,則溶液呈黃色是由Fe3+引起的.因此①中甲同學認為氧化性:Fe3+>Br2,不發生反應,溶液呈黃色是由溴水引起的;②中乙同學認為氧化性:Fe3+<Br2,發生反應生成Fe3+,溶液呈黃色是由Fe3+引起的,故答案為:Br2;Fe3+;
(3)乙同學的觀點認為氧化性:Fe3+<Br2,則會發生反應:2Fe2++Br2═2Fe3++2Br-,由于溴水少量,要全部參與反應,生成物中生成了Fe3+.要證明乙同學的觀點確實正確,設計兩種方案進行實驗.方案一:證明溶液中不存在Br2,根據題意,選擇試劑四氯化碳來進行萃取實驗,由于四氯化碳呈無色、密度大于水、與水不互溶、易溶解Br2,觀察到現象為:出現分層現象,下層為四氯化碳,且呈無色.則證明方案一正確;方案二:證明溶液中存在Fe3+.根據題意,選擇試劑硫氰化鉀溶液,觀察到現象為溶液呈血紅色,則證明方案二正確,
方案一、方案二都正確,即可證明乙同學的觀點確實正確,
故答案為:
| 選用試劑(填序號) | 實驗現象 | |
| 方案1 | b | 下層(CCl4層)無色 |
| 方案2 | d | 溶液變為血紅色 |
點評 本題考查了性質實驗方案的設計與評價,題目難度中等,明確實驗目的為解答關鍵,學生應注意物質的性質及氧化還原反應中電子守恒來分析,試題培養了學生的分析、理解能力及化學實驗能力.


科目:高中化學 來源: 題型:實驗題
 “低碳經濟”已成為科學家研究的主要課題之一.
“低碳經濟”已成為科學家研究的主要課題之一.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 加熱后在空氣中冷卻稱量固體 | B. | 晶體中含有加熱易揮發的雜質 | ||
| C. | 實驗所取晶體已有部分脫水 | D. | 晶體加熱時脫水不完全 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
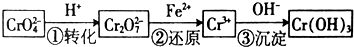
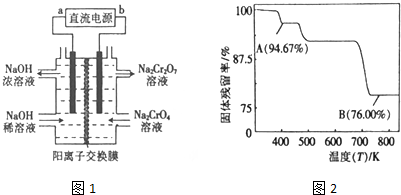
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
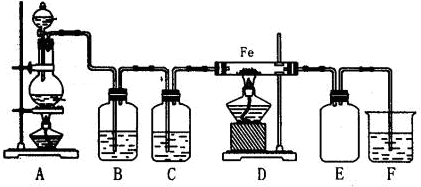
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②④⑤ | B. | ②③⑥⑦ | C. | ②⑤⑥⑦ | D. | ①③⑥⑦ |
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 堿性:NaOH<Mg(OH)2<Al(OH)3 | B. | 第一電離能:Na<Mg<Al | ||
| C. | 電負性:Na>Mg>Al | D. | 還原性:Na>Mg>Al |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 將物質的量均為3.00mol物質A、B混合于5L容器中,發生如下反應:3A+B?2C,在反應過程中C的物質的量分數隨溫度變化如圖所示:
將物質的量均為3.00mol物質A、B混合于5L容器中,發生如下反應:3A+B?2C,在反應過程中C的物質的量分數隨溫度變化如圖所示:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com