
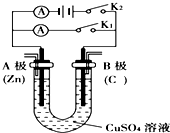
 請按要求回答下列問題.
請按要求回答下列問題.分析 (1)①若斷開K2,閉合K1,形成原電池反應(yīng),Zn為負極,被氧化,Cu為正極,發(fā)生還原反應(yīng)生成銅;
②若斷開K1,閉合K2,為電解池,C為陽極,Zn為陰極,該極上析出金屬銅,根據(jù)電極反應(yīng)書寫總反應(yīng),根據(jù)電子守恒進行計算;
(2)要實現(xiàn)反應(yīng)Cu+H2SO4═CuSO4+H2↑發(fā)生,則金屬銅是陽極,硫酸是電解質(zhì),陰極材料是比銅活潑性差的金屬或非金屬,據(jù)此回答.
解答 解:(1)①若斷開K2,閉合K1,形成原電池反應(yīng),Zn為負極,被氧化而鋅不斷溶解,Zn-2e-=Zn2+,Cu為正極,發(fā)生還原反應(yīng)生成銅,電極方程式為Cu2++2e-═Cu,有紅色物質(zhì)析出,
故答案為:Zn-2e-=Zn2+;在碳棒上析出紅色的銅;
②若斷開K1,閉合K2,為電解池,C為陽極,發(fā)生電極反應(yīng):4OH--4e-=2H2O+O2↑,Zn為陰極,該極上析出金屬銅,發(fā)生Cu2++2e-═Cu,總反應(yīng)是:電解2CuSO4+2H2O$\frac{\underline{\;通電\;}}{\;}$2Cu+O2↑+2H2SO4,Zn為陰極發(fā)生Cu2++2e-═Cu,鋅電極增重ag即$\frac{a}{64}$molCu生成,轉(zhuǎn)移電子是$\frac{a}{32}$mol,陽極發(fā)生電極反應(yīng):4OH--4e-=2H2O+O2↑,生成的氧氣體積是:$\frac{a}{32}$××$\frac{1}{4}$22.4L/mol=0.175aL,
故答案為:4OH--4e-=O2↑+2H2O;2CuSO4+2H2O$\frac{\underline{\;通電\;}}{\;}$2Cu+O2↑+2H2SO4;0.175a;
(2)要實現(xiàn)反應(yīng)Cu+H2SO4═CuSO4+H2↑發(fā)生,則金屬銅失電子,是陽極,陰極上是氫離子得電子的還原反應(yīng),即2H++2e-=H2↑,硫酸是電解質(zhì),陰極材料是比銅活潑性差的金屬或非金屬,此時要形成電解池,應(yīng)打開K1閉合K2,
故答案為:K1; K2; 硫酸溶液; 銅棒;2H++2e-=H2↑.
點評 本題考查了原電池和電解池原理,為高頻考點,側(cè)重于學生的分析、計算能力的考查,知道原電池和電解池區(qū)別,知道各個電極上發(fā)生的電極反應(yīng),再結(jié)合各個物理量之間的關(guān)系式計算,題目難度不大.


 云南師大附小一線名師提優(yōu)作業(yè)系列答案
云南師大附小一線名師提優(yōu)作業(yè)系列答案 沖刺100分單元優(yōu)化練考卷系列答案
沖刺100分單元優(yōu)化練考卷系列答案科目:高中化學 來源: 題型:填空題
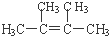 ;
;

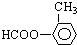 還有:
還有: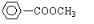 .
.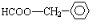 .
.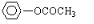
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 分子中至少有12個碳原子處于同一平面上 | |
| B. | 分子中至少有10個碳原子處于同一平面上 | |
| C. | 分子中至少有11個碳原子處于同一平面上 | |
| D. | 該烴屬于苯的同系物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 升高溫度 | B. | 使用催化劑 | C. | 增大壓強 | D. | 增加濃度 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
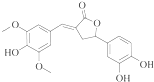
| A. | 分子中含有三種含氧官能團 | |
| B. | 1 mol該化合物最多能與6molNaOH反應(yīng) | |
| C. | 既可以發(fā)生取代反應(yīng),又能夠發(fā)生加成反應(yīng) | |
| D. | 既能與FeC13發(fā)生顯色反應(yīng),也能和Na2CO3反應(yīng) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 實驗或?qū)嶒灢僮?/TD> | 現(xiàn)象 | 實驗結(jié)論 | |
| A | 用大理石和鹽酸反應(yīng)制取CO2 氣體,立即通入一定濃度的Na2SiO3溶液中 | 出現(xiàn)白色沉淀 | H2CO3的酸性比H2SiO3的酸性強 |
| B | 向某溶液先滴加硝酸酸化,再滴加BaCl2溶液 | 出現(xiàn)白色沉淀 | 原溶液中含有SO42-、SO32-、HSO3-中的一種或幾種 |
| C | 將純Zn片與純Cu片用導線連接,浸入到稀硫酸溶液中 | Cu片表面產(chǎn)生大量氣泡 | 金屬性:Zn>Cu |
| D |  | 左邊棉球變?yōu)槌壬疫吤耷蜃優(yōu)樗{色 | 氧化性: Cl2>Br2>I2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com