
| 序號 | 溫度(°C) | 起始濃度(mol•L-1) | 平衡濃度(mol•L-1) | ||||
| CO | H2 | CH3OH | CO | H2 | CH3OH | ||
| ① | T | 1 | 3 | 0 | 0.2 | 1.4 | 0.8 |
| ② | T | 1.5 | 4.6 | 0.1 | b1 | b2 | b3 |
| ③ | T+30 | 1 | 3 | 0 | 0.25 | 1.5 | 0.75 |
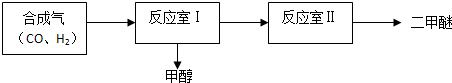
分析 (1)根據通過改變溫度、壓強或者減小生成物濃度使平衡正向移動,則可提高反應室Ⅰ中CO的轉化率;
(2)①序號3平衡時CH3OH小于序號1,則升溫平衡逆向移動結合升溫反應速率加快分析;
②序號2將0.1mol/L的CH3OH全部轉化到左邊,即相對于開始CO濃度1.6mol/L,H2濃度4.8mol/L,與序號1CO濃度1mol/L,H2濃度3mol/L成比例,則序號2相對于序號1增大壓強,所以平衡正向移動,據此分析;
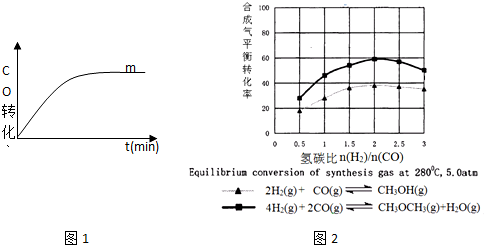
(3)根據圖象可以看出,對于同一反應隨著氫碳比增大,甲醇或二甲醚體積分數先增大后減小;對于不同反應,相同氫碳比,二甲醚體積分數大于甲醇體積分數;
(4)CO(g)+2H2(g)═CH3OH(g)△H1=-100.46kJ•mol-1①
2CH3OH(g)═CH3OCH3(g)+H2O(g)△H2=-20.59kJ•mol-1 ②
根據蓋斯定律①×2+②計算.
解答 解:(1)反應CO(g)+2H2(g)═CH3OH(g),則增大氫氣濃度,平衡正向移動,CO的轉化率增大;不斷分離出甲醇,平衡正向移動,CO的轉化率增大;加壓,平衡正向移動,CO的轉化率增大;故答案為:增大氫氣濃度;不斷分離出甲醇或者加壓;
(2)①由圖表數據,序號3平衡時CH3OH濃度小于序號1,則說明升溫平衡逆向移動,又升溫反應速率加快,所以曲線n相對于曲線m,反應速率快,但平衡平衡逆向移動,CO的轉化率小,則曲線n為: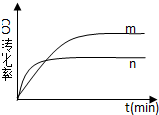 ,故答案為:
,故答案為: ;
;
②序號2將0.1mol/L的CH3OH全部轉化到左邊,即相對于開始CO濃度1.6mol/L,H2濃度4.8mol/L,與序號1CO濃度1mol/L,H2濃度3mol/L成比例,則序號2相對于序號1增大壓強,所以平衡正向移動,又序號1$\frac{c(CH{\;}_{3}OH)}{c(CO)}$=$\frac{0.8}{0.2}$=4,所以序號2$\frac{c(CH{\;}_{3}OH)}{c(CO)}$=$\frac{{b}_{3}}{{b}_{1}}$>4,故答案為:>;
(3)根據圖象可以看出,對于同一反應隨著氫碳比增大,甲醇或二甲醚體積分數先增大后減小,并且氫碳比為2時甲醇或二甲醚體積分數最大,所以按方程式系數比投料時甲醇或二甲醚體積分數最大;對于不同反應,相同氫碳比,二甲醚體積分數大于甲醇體積分數;所以只有C可以從圖中得出;故選:C;
(4)CO(g)+2H2(g)═CH3OH(g)△H1=-100.46kJ•mol-1①
2CH3OH(g)═CH3OCH3(g)+H2O(g)△H2=-20.59kJ•mol-1 ②
根據蓋斯定律①×2+②得:2CO(g)+4H2(g)═CH3OCH3(g)+H2O(g)△H3=2×△H1+△H2=-221.51kJ•mol-1
故答案為:-221.51.
點評 本題考查了外界條件對化學平衡的影響、等效平衡的應用、圖象分析判斷的方法、蓋斯定律的計算等,掌握基礎是解題的關鍵,題目難度中等.


 期末寶典單元檢測分類復習卷系列答案
期末寶典單元檢測分類復習卷系列答案科目:高中化學 來源: 題型:選擇題
 用已知濃度的NaOH溶液測定H2SO4溶液的濃度,所選用的滴定管如圖甲、乙所示,從下表中選出正確選項( )
用已知濃度的NaOH溶液測定H2SO4溶液的濃度,所選用的滴定管如圖甲、乙所示,從下表中選出正確選項( )| 錐形瓶中的溶液 | 滴定管中的溶液 | 選用指示劑 | 選用滴定管 | |
| A. | 堿 | 酸 | 石蕊 | 乙 |
| B. | 酸 | 堿 | 酚酞 | 甲 |
| C. | 堿 | 酸 | 甲基橙 | 乙 |
| D. | 酸 | 堿 | 酚酞 | 乙 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 實驗編號 | 溫度/℃ | 起始時物質的量/mol | 平衡時物質的量/mol | ||
| n(X) | n(Y) | n(M) | |||
| ① | 700 | 0.40 | 0.10 | 0.090 | |
| ② | 800 | 0.10 | 0.40 | 0.080 | |
| ③ | 800 | 0.20 | 0.30 | a | |
| ④ | 900 | 0.10 | 0.15 | b | |
| A. | 實驗①中,若5 min時測得n(M)=0.050 mol,則0至5 min時間內,用N表示的平均反應速率v(N)=1.0×10-2 mol•L-1•min-1 | |
| B. | 實驗②中,該反應的平衡常數K=2.0 | |
| C. | 實驗③中,達到平衡時,X的轉化率為60% | |
| D. | 實驗④中,達到平衡時,b>0.060 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 催化還原CO2是解決溫室效應及能源問題的重要手段之一.研究表明,在Cu/ZnO催化劑存在下,CO2和H2可發生兩個平衡反應,分別生成CH3OH和CO.反應的熱化學方程式如下:
催化還原CO2是解決溫室效應及能源問題的重要手段之一.研究表明,在Cu/ZnO催化劑存在下,CO2和H2可發生兩個平衡反應,分別生成CH3OH和CO.反應的熱化學方程式如下:| T(K) | 催化劑 | CO2轉化率(%) | 甲醇選擇性(%) |
| 543 | Cat.1 | 12.3 | 42.3 |
| 543 | Cat.2 | 10.9 | 72.7 |
| 553 | Cat.1 | 15.3 | 39.1 |
| 553 | Cat.2 | 12.0 | 71.6 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 物質 | X | Y | Z | Q |
| 時間 | ||||
| 起始/mol | 0.7 | 1 | ||
| 2min末/mol | 0.8 | 2.7 | 0.8 | 2.7 |
| 3min末/mol | 0.8 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 根據組成原電池的條件,試以反應:2Fe3++Cu=2Fe2++Cu2+設計一個原電池,
根據組成原電池的條件,試以反應:2Fe3++Cu=2Fe2++Cu2+設計一個原電池,查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 溫度(K) CO2轉化率(%) n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com