

分析 (1)①根據CO轉化率計算消耗CO物質的量,根據v=$\frac{△c}{△t}$計算v(CO),再根據速率之比等于化學計量數之比計算v(N2);
②由題目信息可知,用某組分(B)的平衡壓強(PB)表示平衡常數為:生成物分壓的系數次冪乘積與反應物分壓系數次冪乘積的比;
③正反應為氣體物質的量減小的反應,為熵減反應,而△H-T△S<0反應自發進行;
④從t4時刻正反應速率不變,處于平衡狀態,t4時刻前未到達平衡,反應向正反應進行,由③中可知為反應熱反應,絕熱條件下,隨反應進行溫度升高,溫度起主導作用,反應速率加快,而后濃度為主導因素,反應速率減低至平衡狀態;
(2)使根據K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$計算平衡常數,恒溫恒壓下計算加入3molCO時容器體積,再計算濃度商Qc,若Qc=K,處于平衡狀態,若Qc<K,反應向正反應進行,若Qc>K,反應向逆反應進行;
(3)①增大H2的濃度,平衡右移,CO的轉化率增大;
②通過圖2可知,溫度升高CO的轉化率降低,說明升溫平衡逆向移動,故正反應方向為放熱反應,則溫度越高二甲醚的質量分數越小;
正反應為氣體體積減小的反應,增大壓強平衡正向移動,二甲醚的質量分數增大;
③A.增大反應物濃度,平衡正向移動,正反應速率先增大后減小;
B.逆反應速率先增大后減小,說明平衡逆向移動;
C.化學平衡常數K值增大,說明平衡正向移動;
D.如加入反應物,反應物的體積百分含量增大,但平衡正向移動;
E.移走生成物的量,平衡正向移動,混合氣體總質量減小,容器容積不變,混合氣體密度減小;
F.增大氫氣的物質的量,平衡正向移動,但氫氣轉化率減小.
解答 解:(1)①消耗CO物質的量為1.2mol×20%=0.24mol,v(CO)=$\frac{\frac{0.24mol}{2L}}{2min}$=0.06mol/(L.min),速率之比等于化學計量數之比,則v(N2)=$\frac{1}{2}$v(CO)=0.03mol/(L.min),
故答案為:0.03mol/(L.min);
②由題目信息可知,用某組分(B)的平衡壓強(PB)表示平衡常數為:生成物分壓的系數次冪乘積與反應物分壓系數次冪乘積的比,2NO(g)+2CO(g)?2CO2(g)+N2(g)用某組分(B)的平衡壓強(PB)表示平衡常數KP=$\frac{{p}^{2}(C{O}_{2})×p({N}_{2})}{{p}^{2}(NO)×{p}^{2}(CO)}$,
故答案為:=$\frac{{p}^{2}(C{O}_{2})×p({N}_{2})}{{p}^{2}(NO)×{p}^{2}(CO)}$;
③正反應為氣體物質的量減小的反應,為熵減反應,△S<0,而△H-T△S<0反應自發進行,該反應在低溫下能自發進行,該反應的△H<0,故答案為:<;
④從t4時刻正反應速率不變,處于平衡狀態,t4時刻前未到達平衡,反應向正反應進行,由③中可知為反應熱反應,絕熱條件下,隨反應進行溫度升高,溫度起主導作用,反應速率加快,而后濃度為主導因素,反應速率減低至平衡狀態;
A.反應在c點未達到平衡狀態,故A正確;
B.由圖可知,反應速率a點小于b點,故B正確;
C.反應物濃度a點大于b點,故C正確;
D.NO的轉化率:t1~t2<t2~t3,故D錯誤,
故選:D;
(2)溫度不變,平衡常數不變,平衡常數K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$=$\frac{\frac{1}{3}}{\frac{1}{3}×(\frac{1}{3})^{2}}$=9,通入3mol CO瞬間體積變為3L×$\frac{6}{3}$=6L,濃度商Qc=$\frac{\frac{1}{6}}{\frac{4}{6}×(\frac{1}{6})^{2}}$=9=K,平衡不移動,故v(正)=v(逆),
故答案為:=;溫度不變,平衡常數不變,平衡常數K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$=$\frac{\frac{1}{3}}{\frac{1}{3}×(\frac{1}{3})^{2}}$=9,通入3mol CO瞬間體積變為3L×$\frac{6}{3}$=6L,濃度商Qc=$\frac{\frac{1}{6}}{\frac{4}{6}×(\frac{1}{6})^{2}}$=9=K,平衡不移動;
(3)①增大H2的濃度,平衡右移,CO的轉化率增大,故有a>b>c,
故答案為:a>b>c;
②通過圖2可知,溫度升高CO的轉化率降低,說明升溫平衡逆向移動,故正反應方向為放熱反應,則溫度越高二甲醚的質量分數越小,故溫度:T1>T2>T3>T4;
正反應為氣體體積減小的反應,增大壓強平衡正向移動,二甲醚的質量分數增大,故壓強P1>P2>P3>P4,
故選:BD;
③A.增大反應物濃度,平衡正向移動,正反應速率先增大后減小,不一定逆向移動,故A錯誤;
B.逆反應速率先增大后減小,說明平衡逆向移動,故B正確;
C.化學平衡常數K值增大,說明平衡正向移動,故C錯誤;
D.如加入反應物,反應物的體積百分含量增大,但平衡正向移動,故D錯誤;
E.移走生成物的量,平衡正向移動,混合氣體總質量減小,容器容積不變,混合氣體密度減小,故E錯誤;
F.增大氫氣的物質的量,平衡正向移動,但氫氣轉化率減小,故F錯誤,
故選:B.
點評 本題考查化學平衡計算與影響因素、化學平衡圖象、平衡狀態建立、反應速率計算、平衡常數應用等,式對學生綜合能力考查,難度中等,(2)為易錯點,學生容易忽略體積變化.


 第1卷單元月考期中期末系列答案
第1卷單元月考期中期末系列答案科目:高中化學 來源: 題型:解答題

 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1:1 | B. | 2:1 | C. | 3:4 | D. | 5:4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ②③⑥ | B. | ③⑥ | C. | ①②④ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 煤和水煤氣均是二次能源 | |
| B. | 煤中含有苯、甲苯、二甲苯等有機物 | |
| C. | ①是將煤在空氣中加強熱使其分解的過程 | |
| D. | B為甲醇或乙酸時,原子利用率均達到100% |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | “APEC藍”是2014年新的網絡詞匯,形容2014年APEC會議期間北京藍藍的天空.說明京津冀實施道路限行和污染企業停工等措施,對減輕霧霾、保證空氣質量是有效的 | |
| B. | “地溝油”經過加工處理后,可以用來制肥皂和生物柴油 | |
| C. | 生石灰、鐵粉、硅膠是食品包裝中常用的干燥劑 | |
| D. | 有機垃圾發酵生產沼氣 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
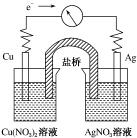 將反應Cu(s)+2Ag+(aq)═Cu2+(aq)+2Ag(s)設計成原電池,某一時刻的電子流向及電流計(G)指針偏轉方向如圖所示,下列有關敘述正確的是( )
將反應Cu(s)+2Ag+(aq)═Cu2+(aq)+2Ag(s)設計成原電池,某一時刻的電子流向及電流計(G)指針偏轉方向如圖所示,下列有關敘述正確的是( )| A. | KNO3鹽橋中的K+移向Cu(NO3)2溶液 | |
| B. | Cu作負極,發生還原反應 | |
| C. | 電子由AgNO3溶液通過鹽橋移向Cu(NO3)2溶液 | |
| D. | 工作一段時間后,AgNO3溶液中c(Ag+)減小 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 該反應的熱化學方程式為: $\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)?NH3(g),△H=-92kJ•mol-1 | |
| B. | 不用催化劑,生成 1molNH3放出的熱量為46 KJ | |
| C. | 加入催化劑,生成 1molNH3的反應熱減小50 KJ•mol-1 | |
| D. | 在溫度體積一定的條件下,通入1molN2和3molH2,反應后放出的熱量為Q1,若通入2molN2和6molH2,反應后放出的熱量為Q2,則Q1=0.5Q2<92KJ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com