
| A. | 3.0g | B. | 3.5g | C. | 5.5g | D. | 5.6g |
分析 解法一:鎂離子、鋁離子轉化成沉淀時結合的氫氧根離子與生成氫氣轉移的電子的物質的量相等,據此可計算出沉淀中氫氧根離子的物質的量,再根據計算的質量計算出生成沉淀的最大質量即可;
解法二:設出鎂和鋁的物質的量,分別根據總質量、生成氫氣的量列式計算出二者的物質的量;當氫氧化鈉過量時,沉淀只有氫氧化鎂此時沉淀的質量最小;當氫氧化鈉適量,鎂離子和鋁離子恰好生成氫氧化鎂、氫氧化鋁沉淀,此時沉淀的質量最大,據此得出生成沉淀的質量范圍,然后對選項進行判斷.
解答 解:解法-:標況下2240mL H2的物質的量為:$\frac{2.24L}{22.4L/mol}$=0.1mol,生成0.1mol氫氣需要得到電子的物質的量為:0.1mol×2=0.2mol,
根據關系式可得:Mg~2e-~Mg2+~2OH-、Al~3e-~Al3+~3OH-,鎂離子和鋁離子完全轉化成沉淀時,結合氫氧根離子的物質的量=電子的總物質的量=0.2mol,
則生成沉淀的最大質量為:2.1g+17g/mol×0.2mol=5.5g,即:生成沉淀的總質量≤5.5g,故D不可能,
故選D;
解法二:設混合物中含有Mg、Al的物質的量分別為x、y,
根據總質量可得:①24x+27y=2.1g,
標況下2240mL H2的物質的量為:$\frac{2.24L}{22.4L/mol}$=0.1mol,
根據電子守恒及氫氣的物質的量可得:②2x+3y=0.1mol×2,
聯立①②可得:x=0.05mol、y=$\frac{1}{30}$mol,
即:混合金屬中含有0.05molMg、$\frac{1}{30}$molAl,
當氫氧化鈉過量時,鋁離子完全轉化成偏鋁酸根離子,生成的沉淀只有氫氧化鎂,此時生成沉淀的質量最小,則沉淀的最小質量為:58g/mol×0.05mol=2.9g;
當氫氧化鈉適量,鋁離子和鎂離子恰好生成沉淀,此時生成沉淀的質量最大,則生成沉淀的最大質量為:2.9g+78g/mol×$\frac{1}{30}$mol=5.5g,
所以生成沉淀的質量范圍為:2.9<m≤5.5g,
選項中不可能的為D,
故選D.
點評 本題考查了混合物反應的計算,題目難度中等,明確發生反應的實質為解答關鍵,注意掌握質量守恒定律、討論法在化學計算中的應用方法,試題培養了學生的分析能力及化學計算能力.


科目:高中化學 來源: 題型:選擇題
| A. | 實驗室中“通風廚”能排出有害的氣體,能防止有害氣體污染大氣環境 | |
| B. | 減少碳氫化合物、氮氧化物的排放可以有效的防止光化學煙霧的產生 | |
| C. | 處理廢棄塑料制品較為合理的方法是用化學方法將廢棄塑料加工成防水涂料或汽油 | |
| D. | 對廢棄電池進行集中回收后處理的主要目的是防止重金離子的污染 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 二氧化碳增多使太陽輻射到地球表面的能量增多 | |
| B. | 二氧化碳等氣體能釋放能量,使大氣層的溫度升高 | |
| C. | 氟氯烴等大量排放,破壞臭氧層引起的 | |
| D. | 二氧化碳、甲烷等溫室氣體產生溫室效應,使大氣溫度升高,加速冰層融化 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
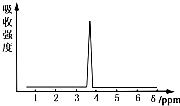 在有機物分子中,不同氫原子的核磁共振氫譜中給出的峰值(信號)也不同,根據峰值(信號)可以確定有機物分子中氫原子的種類和數目.
在有機物分子中,不同氫原子的核磁共振氫譜中給出的峰值(信號)也不同,根據峰值(信號)可以確定有機物分子中氫原子的種類和數目.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
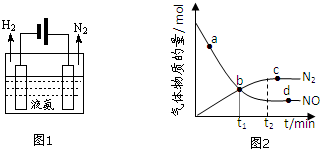
| 共價鍵 | H-H | N-H | N≡N |
| 能量變化/kJ•mol-1 | 436 | 390.8 | 946 |
| NH3質量分數17%的氨水 | 無水NH4HSO3 | |
| 價格(元/kg) | 1.0 | 1.8 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
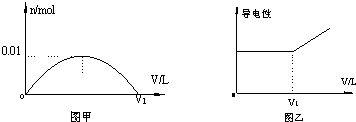
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
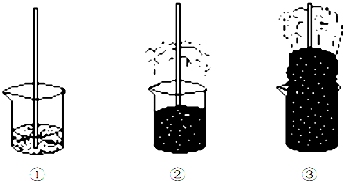
| A. | ②中現象說明濃硫酸具有很強的脫水性 | |
| B. | ③中現象說明濃硫酸具有很強的酸性 | |
| C. | ③中生成刺激性氣味氣體說明濃硫酸具有很強的氧化性 | |
| D. | ③中產生的氣體通入品紅溶液,可以觀察到紅色褪去 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鋁與CuSO4溶液反應:3Al+2Cu2+═2Cu+3Al3+ | |
| B. | 向Ba(OH)2溶液中加過量NaHCO3溶液:HCO3-+Ba2++OH-=H2O+BaCO3↓ | |
| C. | 澄清石灰水與鹽酸反應:H++OH-=H2O | |
| D. | 氯化鋁溶液中加入過量氨水:Al3++4NH3•H2O═4NH4++Al(OH)4- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com