
| A. | 配制90mL1.00mol/L的NaCl溶液,用托盤天平稱取5.3gNaCl固體 | |
| B. | 使用容量瓶時,先檢驗其是否漏水,然后洗凈后,不用干燥即可使用 | |
| C. | 可用10mL量筒量取8.58mL蒸餾水 | |
| D. | 在配制溶液定容后,上下翻轉搖勻后發現液面下降,須加水至溶液凹液面與刻度線相切 |
分析 A.配制90mL溶液,需要100mL容量瓶,結合m=cVM計算;
B.容量瓶有塞子,需要查漏,定容還需加水,則不需要干燥;
C.量筒的感量為0.1mL;
D.配制溶液定容后,上下翻轉搖勻后發現液面下降,為正常現象,液體可殘留在塞子處.
解答 解:A.配制90mL溶液,需要100mL容量瓶,NaCl的質量m=0.1L×1.00mol/L×58.5g/mol=5.85g,則用托盤天平稱取5.8g或5.9gNaCl固體,故A錯誤;
B.容量瓶有塞子,需要查漏,定容還需加水,則不需要干燥,則使用容量瓶時,先檢驗其是否漏水,然后洗凈后,不用干燥即可使用,故B正確;
C.量筒的感量為0.1mL,則用10mL量筒量取8.5mL或5.9mL蒸餾水,故C錯誤;
D.配制溶液定容后,上下翻轉搖勻后發現液面下降,為正常現象,液體可殘留在塞子處,不能再加水至溶液凹液面與刻度線相切,故D錯誤;
故選B.
點評 本題考查化學實驗方案的評價,為高頻考點,把握溶液配制的儀器、步驟及操作為解答的關鍵,側重分析與實驗能力的考查,注意實驗的評價性分析,題目難度不大.


 備戰中考寒假系列答案
備戰中考寒假系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
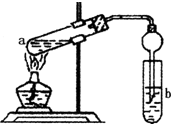 如圖,在左試管中先加入2mL 95%的乙醇,并在搖動下緩緩加入3mL濃硫酸,再加入2mL乙酸,充分搖勻.在右試管中加入5mL飽和Na2CO3溶液.按圖連接好裝置,用酒精燈對左試管小火加熱3~5min后,改用大火加熱,當觀察到右試管中有明顯現象時停止實驗.
如圖,在左試管中先加入2mL 95%的乙醇,并在搖動下緩緩加入3mL濃硫酸,再加入2mL乙酸,充分搖勻.在右試管中加入5mL飽和Na2CO3溶液.按圖連接好裝置,用酒精燈對左試管小火加熱3~5min后,改用大火加熱,當觀察到右試管中有明顯現象時停止實驗.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
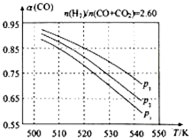 甲醇是重要的化工原料,又可做為燃料.利用合成氣(主要成分為CO、CO2和H2)在催化劑的作用下合成甲醇,發生的主反應如下:
甲醇是重要的化工原料,又可做為燃料.利用合成氣(主要成分為CO、CO2和H2)在催化劑的作用下合成甲醇,發生的主反應如下:| 物質 | CO | CO2 | H2 | CH3OH(g) |
| 標準生成熱(kJ/mol) | -110.52 | -393.51 | 0 | -201.25 |
| 容器編號 | 溫度(℃) | 起始物質的量(mol) | 平衡物質的量(mol) | |||
| CH3OH(g) | CH3OCH3(g) | H2O(g) | CH3OCH3(g) | H2O(g) | ||
| a | 387 | 0.20 | 0 | 0 | 0.080 | 0.080 |
| b | 387 | 0.40 | 0 | 0 | ||
| c | 207 | 0.20 | 0 | 0 | 0.090 | 0.090 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | v(CO)=1.2 mol/(L•s) | B. | v(NO2)=0.3 mol/(L•min) | ||
| C. | v(N2)=0.6 mol/(L•min) | D. | v(CO2)=1.2 mol/(L•min) |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題


查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | SiO2是酸性氧化物,能與NaOH溶液反應生成鹽和水 | |
| B. | 實驗室中用石灰水區分Na2CO3與NaHCO3兩瓶無標簽溶液 | |
| C. | O3和O2為同種元素組成的單質,所以O3和O2互為同位素 | |
| D. | Na2O和Na2O2組成元素相同,與H2O的反應產物也相同 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com