
下列離子方程式書寫不正確的是( )
A.AlCl3溶液與燒堿溶液反應,當n(OH-):n(Al3+)=7:2時,2Al3+ + 7OH-=Al(OH)3↓+ AlO2- + 2H2O
B.CuCl2溶液與NaHS溶液反應,當n(CuCl2):n(NaHS)=1:2時Cu2++2HS-=CuS↓+H2S↑
C.Cl2與FeBr2溶液反應,當n(Cl2):n(FeBr2)=1:1時,2Fe2+ + 4Br- +3Cl2=2 Fe3+ + 2Br2 + 6Cl-
D.Fe與稀硝酸反應,當n(Fe):n(HNO3)=1:2時,3 Fe +2NO3- +8H+=3Fe2+ +2NO↑+4H2O
 優質課堂快樂成長系列答案
優質課堂快樂成長系列答案科目:高中化學 來源:2016-2017學年山東省濰坊市高一下學期第一次月考模擬測試化學試卷(解析版) 題型:填空題
現有部分短周期元素的性質或原子結構如下表:
元素編號 | 元素性質或原子結構 |
X | 最外層電子數是次外層電子數的2倍 |
Y | 常溫下單質為雙原子分子,其氫化物水溶液呈堿性 |
Z | 第三周期元素的簡單離子中半徑最小 |
(1)元素X的一種同位素可測定文物年代,這種同位素的符號是____________(用元素符號表示)元素Z的離子結構示意圖為_________________。
(2)金屬鎂可以在元素X的最高價氧化物中燃燒的化學方程式:______________
(3)元素Y的與氫元素形成一種離子YH4+,寫出其電子式_________________。
(4)寫出Z元素最高價氧化物與NaOH溶液反應的離子方程式:_______________。
(5)元素X與元素Y相比,非金屬性較強的是______(用元素符號表示)。下列表述中證明這一事實的是____________。
a.常溫下X的單質和Y的單質狀態不同
b.Y的最高價氧化物水化物的酸性比X的最高價氧化物水化物的酸性強
c.X與Y形成的化合物中X元素呈正價態
(6)探尋物質的性質差異性是學習的重要方法之一。X、Y、Z三種元素的單質中化學性質明顯不同于其他兩種單質是___________(用元素符號表示),理由_________。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年湖南省株洲市高一下學期第一次月考化學試卷(解析版) 題型:選擇題
在下列物質分類中,前者包含后者的是
A. 氧化物、含氧酸 B. 化合物、非電解質
C. 溶液、膠體 D. 電解質、氯化鈉溶液
查看答案和解析>>
科目:高中化學 來源:2017屆山東省菏澤市高三一模理綜化學試卷(解析版) 題型:選擇題
用NA表示阿伏伽德羅常數的數值,下列說法正確的是
A. 1molNa218O2中所含的中子數為42NA
B. 9.8g由H2SO4和H3PO4組成的混合物中含有的氧原子數為0.4NA
C. 2mol·L-1的FeCl3溶液溶液中含有的Fe3+數目小于2NA
D. 1mol環己烷中含有的共價鍵數為12NA
查看答案和解析>>
科目:高中化學 來源:2017屆遼寧省高三第五次模擬考試理綜化學試卷(解析版) 題型:選擇題
下列有關電解質溶液的說法正確的是( )
A. 濃度均為0.1 mol•L﹣1的①(NH4)2CO3 ②(NH4)2SO4 ③(NH4)2Fe(SO4)2溶液中,c(NH4+)的大小順序為:③<②<①
B. 工業上常用Na2SO3溶液作為吸收液脫除煙氣中的SO2 ,隨著SO2的吸收,吸收液的pH不斷變化。當吸收液呈酸性時:c (Na+)=c (SO32﹣)+c (HSO3﹣)+c (H2SO3)
C. 常溫下,將0.1 mol•L﹣1 CH3COOH溶液加水稀釋,當溶液的pH從3.0升到5.0時,溶液中c(CH3COO-)/c(CH3COOH)的值增大到原來的100倍
D. 向0.2 mol/LNaHCO3溶液中加入等體積0.1 mol/L NaOH溶液:c(CO32﹣)>c(HCO3﹣)>c(OH﹣)>c(H+)
查看答案和解析>>
科目:高中化學 來源:2017屆遼寧省撫順市高三3月模擬考試理科綜合化學試卷(解析版) 題型:簡答題
德國化學家哈伯(F. Haber, 1868-1930)發明的合成氨技術使大氣中的氮氣變成了生產氮肥的永不枯竭的廉價來源,從而使農業生產依賴土壤的程度減弱,解決了地球上因糧食不足導致的饑餓和死亡問題。因此這位解救世界糧食危機的化學天才獲得了1918年諾貝爾化學獎。現在我們在實驗室模擬工業制氨的過程,以探究外界條件對平衡的影響。
查閱資料,獲得以下鍵能數據:
化學鍵 | N≡N | H-H | N-H |
鍵能/(kJ/mol) | 946 | 436 | 391 |
(1)計算工業合成氨反應的反應熱:N2(g)+3H2(g)  2NH3(g) △H=________ kJ/mol
2NH3(g) △H=________ kJ/mol
(2)一定溫度下,向一個恒壓容器中充入N20.6mol,H2 0 .5mol,在一定溫度下進行反應:N2(g)+3H2(g)  2NH3(g),達到平衡時,N2的轉化率為1/6,此時容器的體積為1L。
2NH3(g),達到平衡時,N2的轉化率為1/6,此時容器的體積為1L。
①該溫度時容器中平衡體系的平衡常數是______________。
②若保持平衡時的溫度和壓強不變,繼續向平衡體系中通入0.9mol N2,則平衡將_______(填“正向”,“逆向”或“不”)移動。
(3)在兩個壓強相等,溫度分別為T1和T2的容器中充入由1 mol N2和3 molH2組成的混合氣體,發生反應N2(g)+3H2(g)  2NH3(g),平衡后改變容器體積,容器內 N2的體積分數隨壓強的變化如圖所示。據圖判斷下列說法正確的是______________
2NH3(g),平衡后改變容器體積,容器內 N2的體積分數隨壓強的變化如圖所示。據圖判斷下列說法正確的是______________
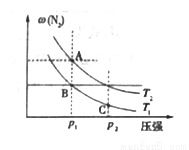
a.A、 B、 C三點的平衡常數大小關系:KA<KB<KC
b.B點和C點的H2濃度大小關系:B<C
c.A點和B點混合氣體的密度大小關系:A<B
d.A點和C點混合氣體的平均相對分子質量大小關系:A>C
(4)合成氨工業會產生大量副產物CO2,工業上常用高濃度的K2CO3溶液吸收CO2,,得溶液X,再利用電解法K2CO3溶液再生,其裝置如圖所示:
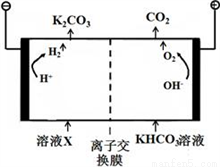
①在陽極區發生的反應包括____________________和H++ HCO3-=H2O+CO2↑。
②簡述CO32-在陰極區再生的原理________________。
③再生裝置中產生的CO2和H2在一定條件下反應生成甲醇,工業上利用該反應合成甲醇。
已知:25 ℃,101 KPa下:
2H2(g)+ O2(g)=2H2O(g) Δ H1=-484kJ/mol
2CH3OH(g)+3 O2(g)=2CO2 (g)+4H2O(g) Δ H2=-1352kJ/mol
寫出CO2和H2生成1molCH3OH(g)的熱化學方程式_______________。
查看答案和解析>>
科目:高中化學 來源:2017屆遼寧省撫順市高三3月模擬考試理科綜合化學試卷(解析版) 題型:選擇題
設NA為阿伏伽德羅常數的值,下列說法正確的是
A. 1.0 L 0. 5mol/L的Na2SO4水溶液中含有的氧原子數為2NA
B. 用含有0.2mo1 FeCl3的飽和溶液配制的氫氧化鐵膠體中膠粒數等于0.2NA
C. 1. 0gH218O與D2O的混合物所含中子數為0.5NA
D. 標準狀況下,11.2L氯氣與足量鐵粉充分反應,轉移的電予數為1.5NA
查看答案和解析>>
科目:高中化學 來源:2017屆浙江省寧波市高三新高考選考適應性考試化學試卷(解析版) 題型:選擇題
鋅一空氣電池(原理如圖)適宜用作城市電動車的動力電源。該電池放電時Zn轉化為ZnO。該電池工作時,下列說法正確的是
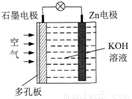
A. Zn電極是該電池的正極
B. Zn電極的電極反應:Zn+H2O-2e-=ZnO+2H+
C. OH-向石墨電極移動
D. 氧氣在石墨電極上發生還原反應
查看答案和解析>>
科目:高中化學 來源:2016-2017學年福建省四地六校高二下學期第一次聯考(3月)化學試卷(解析版) 題型:選擇題
①正丁烷 ②2-甲基丙烷 ③正戊烷 ④2-甲基丁烷 ⑤2,2-二甲基丙烷五種物質,以下說法正確的是( )
A. ①、③無支鏈,且分子中碳原子共直線 B. ③、④、⑤互為同分異構體
C. ①、 ②、③互為同系物 D. 沸點比較:⑤>④>③>②>①
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com