
 工業上制取冰晶石(Na3AlF6)的化學方程式如下:2Al(OH)3+12HF+3A=2Na3AlF6+3CO2↑+9H2O 根據題意完成下列填空:
工業上制取冰晶石(Na3AlF6)的化學方程式如下:2Al(OH)3+12HF+3A=2Na3AlF6+3CO2↑+9H2O 根據題意完成下列填空: .
.分析 (1)根據元素守恒知,A中含有Na、C元素,根據原子守恒知,還含有O元素,且Na、C、O原子個數分別是2、1、3,所以A為Na2CO3;由陰陽離子構成的晶體為離子晶體;
(2)分子晶體由分子構成,正負電荷中心不重合的分子為極性分子;分子晶體的熔沸點與分子間作用力有關,氫鍵導致物質的熔沸點升高;氫鍵的存在導致冰中空間利用率較低;
(3)反應物中有兩種元素在元素周期表中位置相鄰,為O、F元素,元素的非金屬性越強,其單質的氧化性越強,可以根據非金屬單質之間的置換反應判斷非金屬性強弱;同一周期中,元素的電負性隨著原子序數增大而增大,所以F元素電負性大于O元素,O原子最外層電子為其價電子,分別位于2s、2p軌道上;
(4)同一周期元素,元素的第一電離能隨著原子序數增大而呈增大趨勢,但第IIA族、第VA族元素第一電離能大于其相鄰元素,同一主族元素中,元素第一電離能隨著原子序數增大而減小;
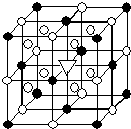
(5)該晶胞中●個數=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,○個數=12×$\frac{1}{4}$+8=11,根據化學式知,冰晶石中陽離子和陰離子個數之比為3:1,據此判斷大立方體的體心處▽所代表的微粒.
解答 解:(1)根據元素守恒知,A中含有Na、C元素,根據原子守恒知,還含有O元素,且Na、C、O原子個數分別是2、1、3,所以A為Na2CO3;由陰陽離子構成的晶體為離子晶體,碳酸鈉是由鈉離子和碳酸根離子構成的,為離子晶體,故答案為:Na2CO3;離子;
(2)分子晶體由分子構成,正負電荷中心不重合的分子為極性分子,二氧化碳和H2O都是分子晶體,二氧化碳是直線形分子、H2O是V形,二氧化碳中正負電荷中心重合為非極性分子,H2O中正負電荷中心不重合,為極性分子;
分子晶體的熔沸點與分子間作用力有關,氫鍵導致物質的熔沸點升高,二氧化碳中不含氫鍵、H2O中含有氫鍵,所以熔沸點較高的是H2O;
氫鍵的存在導致冰中空間利用率較低,所以這兩種物質中密度較大的是CO2,
故答案為:H2O;H2O;CO2;
(3)反應物中有兩種元素在元素周期表中位置相鄰,為O、F元素,元素的非金屬性越強,其單質的氧化性越強,非金屬性較強的單質能置換出非金屬較弱的單質,氟氣能和水反應置換出氧氣,反應方程式為2F2+2H2O=4HF+O2;同一周期中,元素的電負性隨著原子序數增大而增大,所以F元素電負性大于O元素,O原子最外層電子為其價電子,分別位于2s、2p軌道上,則O原子價層電子排布圖為 ,
,
故答案為:2F2+2H2O=4HF+O2; ;
;
(4)同一周期元素,元素的第一電離能隨著原子序數增大而呈增大趨勢,但第IIA族、第VA族元素第一電離能大于其相鄰元素,同一主族元素中,元素第一電離能隨著原子序數增大而減小,所以這幾種元素第一電離能大小順序是F>O>C>Al>Na,故答案為:F>O>C>Al>Na;
(5)該晶胞中●個數=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,○個數=12×$\frac{1}{4}$+8=11,根據化學式知,冰晶石中陽離子和陰離子個數之比為3:1,要使陽離子、陰離子個數之比為3:1,則大立方體的體心處▽所代表的微粒是Na+,
故答案為:Na+.
點評 本題考查晶胞計算、電負性、電離能、原子核外電子排布等知識點,為高考高頻點,知道電離能規律及反常現象、構造原理等知識點,注意(2)中氫鍵的存在影響冰的密度,為易錯點.


 陽光課堂課時優化作業系列答案
陽光課堂課時優化作業系列答案科目:高中化學 來源: 題型:選擇題
| A. | 12C60是一種新型化合物 | B. | C60和石墨是碳的同素異形體 | ||
| C. | 12C60具有離子鍵 | D. | 12C60的摩爾質量是720 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

 .
.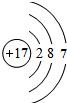 ,其最高價氧化物對應的水化物的化學式為HClO4.
,其最高價氧化物對應的水化物的化學式為HClO4.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原子半徑:W>Z>Y>X>M | |
| B. | XZ2、X2M2、W2Z2均為共價化合物 | |
| C. | 由Z、M兩種元素形成化合物的分子式一定為M2Z | |
| D. | 由 X、Y、Z、M 四種元素形成的化合物可以既有離子鍵,又有共價鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
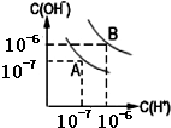 (1)室溫下,在pH=12的NaCN溶液中,由水電離的c(OH-)為10-2 mol•L-1.
(1)室溫下,在pH=12的NaCN溶液中,由水電離的c(OH-)為10-2 mol•L-1.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| 微粒代碼 | a | b | c | d | e | f | g |
| 原子核數目 | 單核 | 單核 | 雙核 | 多核 | 單核 | 多核 | 多核 |
| 帶電荷數(單位電荷) | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.01mol | B. | 0.02mol | C. | 0.03mol | D. | 0.04mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫下,含1 mol Fe的鐵片與過量濃HNO3反應,轉移電子的數目為3 NA個 | |
| B. | 19.2 g銅與足量的稀硝酸反應產生NO的體積為4.48 L | |
| C. | 標準狀況下,33.6 L SO3含有9.03×1023個SO3分子 | |
| D. | 在46 gNO2和N2O4的混合物氣體中所含原子總數為3NA個 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com