
【題目】Ⅰ.用98%的濃硫酸(其密度為1.84g/cm3)配制240mL1.0mol/L稀硫酸,若實驗儀器有:量筒、燒杯、玻璃棒
(1)需量取濃硫酸的體積為___mL;
(2)實驗時還需要的儀器有___;
(3)配制過程中,下列情況會使配制結果偏高的是___(填序號)
①容量瓶使用時未干燥
②定容后經振蕩,搖勻,靜置,發現液面低于刻度線,再加蒸餾水補至刻度線
③移液后未洗滌燒杯和玻璃棒
④定容時仰視刻度線觀察液面
⑤量取濃H2SO4后,用蒸餾水洗滌量筒內壁,并將洗滌液注入燒杯中,一并移液
Ⅱ.請計算28gKOH固體必須溶解在___g水中,才使200個水分子中有1個K+;所得溶液的密度為![]() g/cm3,則該溶液中OH-的物質的量濃度為___(保留到小數點后兩位)。
g/cm3,則該溶液中OH-的物質的量濃度為___(保留到小數點后兩位)。
【答案】13.6 250mL容量瓶,膠頭滴管 ⑤ 1800 0.27![]() mol/L
mol/L
【解析】
Ⅰ.因為實驗室沒有240mL的容量瓶,所以應選擇250mL的容量瓶,計算時,應使用所選容量瓶的規格進行計算。
(1)c(濃硫酸)=![]() mol/L=18.4mol/L
mol/L=18.4mol/L
V(濃硫酸)=![]()
答案為:13.6
(2)實驗時還需要的儀器有250mL容量瓶,膠頭滴管。
答案為:250mL容量瓶,膠頭滴管
(3)①容量瓶使用時未干燥,對所配溶液的濃度不產生影響;
②定容后經振蕩,搖勻,靜置,發現液面低于刻度線,再加蒸餾水補至刻度線,相當于水的加入量多,將導致溶液濃度偏低;
③移液后未洗滌燒杯和玻璃棒,溶質的量減少,所配溶液的濃度偏低;
④定容時仰視刻度線觀察液面,溶液的體積偏大,溶液的濃度偏低;
⑤量取濃H2SO4后,用蒸餾水洗滌量筒內壁,并將洗滌液注入燒杯中,一并移液,溶質的量增多,溶液的濃度偏高。
故選⑤
Ⅱ.n(KOH)=![]() ,n(K+)=0.5mol
,n(K+)=0.5mol
為使200個水分子中有1個K+,n(H2O)=0.5mol×200=100mol
m(H2O)=100mol×18g/mol=1800g
答案為:1800g
c(OH-)=c(KOH)=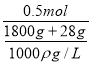 =0.27ρmol/L
=0.27ρmol/L
答案為:0.27![]() mol/L
mol/L


 中考利劍中考試卷匯編系列答案
中考利劍中考試卷匯編系列答案 教育世家狀元卷系列答案
教育世家狀元卷系列答案 黃岡課堂作業本系列答案
黃岡課堂作業本系列答案科目:高中化學 來源: 題型:
【題目】在一定條件下,苯與氯氣在氯化鐵催化下連續反應,生成以氯苯、氯化氫為主要產物,鄰二氯苯、對二氯苯為次要產物的粗氯代苯混合物。有關物質的沸點、熔點如圖,下列說法不正確的是( )
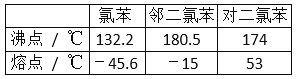
A. 該反應屬于取代反應
B. 反應放出的氯化氫可以用水吸收
C. 用蒸餾的方法可將鄰二氯苯從有機混合物中首先分離出來
D. 從上述兩種二氯苯混合物中,用冷卻結晶的方法可將對二氯苯分離出來
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗事實不能用平衡移動原理解釋的是 ( )
A. 升高溫度水的離子積增大
B. 鎂條與氯化銨溶液反應生成氫氣
C. 碳酸鈣與稀鹽酸反應生成二氧化碳
D. 加入少量硫酸銅可增大鋅與稀硫酸反應的速率
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知下列分子或離子在酸性條件下都能氧化KI,自身發生如下變化:H2O2→H2O IO![]() →I2 MnO
→I2 MnO![]() →Mn2+ HNO2→NO。如果分別用等物質的量的這些物質氧化足量的KI,得到I2最多的是( )
→Mn2+ HNO2→NO。如果分別用等物質的量的這些物質氧化足量的KI,得到I2最多的是( )
A. H2O2 B. HNO2 C. MnO![]() D. IO
D. IO![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到氣體VL(標況下),向反應后的溶液中(存在Cu2+和SO42-)加入足量NaOH,產生藍色沉淀,過濾,洗滌,灼燒,得到CuO12.0g,若上述氣體為NO和NO2的混合氣體,且體積比為1:1,則V可能為( )
A.8.4LB.13.5LC.10.7LD.16.8L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:![]() 時
時
化學式 |
|
|
|
電離平衡常數 |
|
|
|
下列說法正確的是 ( )
A. 醋酸稀釋過程中,![]() 逐漸減小
逐漸減小
B. ![]() 溶液中:
溶液中:![]()
C. 向醋酸或HCN溶液中加入![]() ,均產生
,均產生![]()
D. 物質的量濃度相同時![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某校化學興趣小組在探究新制飽和氯水成分的實驗中,根據實驗現象推測的有關結論中錯誤的是
A.向氯水中滴入紫色石蕊溶液看到其先變紅后褪色,推測氯水中含有Cl2分子
B.向氯水中滴加硝酸酸化的AgNO3溶液,產生白色沉淀,推測氯水中可能含有Cl-
C.向氯水中加入碳酸鈉粉末,有氣泡產生,推測氯水中含有H+
D.氯水放置一周后pH將變大,說明氯水中含有ClO-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】從含有CuCl2、FeCl2、FeCl3的工業廢液中回收銅并制備氯化鐵晶體的流程如下:
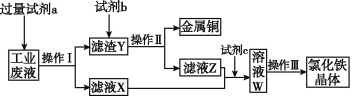
則下列說法正確的是
A. 試劑a是鐵,試劑b是稀硫酸
B. 操作Ⅰ、操作Ⅱ、操作Ⅲ所用的儀器完全相同
C. 試劑c是氯氣,反應的離子方程式為2Fe2++Cl2![]() 2Fe3++2Cl-
2Fe3++2Cl-
D. 用KSCN溶液可檢驗溶液W中是否有Fe2+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】粉煤灰是燃煤電廠的廢渣,主要成分為SiO2、Al2O3、Fe2O3和C等。實驗室模擬工業從粉煤灰提取活性Al2O3,其流程如下圖:
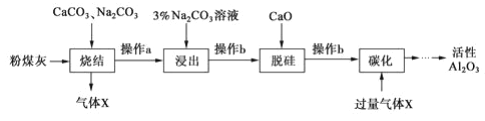
已知燒結過程的產物主要是NaAlO2、Ca2SiO4、NaFeO2和Na2SiO3等。
(1)寫出燒結過程中鋁元素轉化的化學方程式___。
(2)操作 a 為冷卻、研磨,其中研磨的目的是___。
(3)①浸出過程中, NaFeO 2 可完全水解,生成沉淀為___。
②3%Na2 CO3溶液顯___(填 “酸性 ”、 “堿性 ”或“中性 ”),請用離子方程式解釋:___。
(4)操作b 所用的玻璃儀器有漏斗、___、___。
(5)“碳化”時,通入過量氣體 x 主要成分的化學式為___。
(6)工業上電解Al2O3制備 Al 是為使Al2O3在較低溫下融化,通常加入___。電解過程中做陽極的石墨易消耗,原因是___。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com