
【題目】M、X、N、Z、Y原子序數依次增大的短周期的五種主族元素,其中X、Z同主族,Y、Z同周期,M與X,Y既不同族,也不同周期。X原子最外層電子數是核外電子層數的三倍,Y的最高化合價與其最低化合價的代數和等于6。N是短周期主族元素中原子半徑最大的非金屬元素。
(1)請寫出下列元素的元素名稱:X________,M________。
(2) Y在周期表中的位置______________,寫出Z的氫化物的電子式_____________
(3) N的氧化物與氫氧化鈉溶液反應的化學方程式_________________。
(4)Y與Z的最高價氧化物對應水化物的酸性強弱順序________>________(用化學式表示)。
【答案】氧 氫 第三周期ⅦA族 ![]() SiO2+2NaOH=Na2SiO3+H2O HClO4 H2SO4
SiO2+2NaOH=Na2SiO3+H2O HClO4 H2SO4
【解析】
M、X、N、Z、Y原子序數依次增大的短周期的五種主族元素,X原子最外層電子數是核外電子層數的三倍,則X位于第二周期,最外層含有6個電子,為O元素;X、Z同主族,則Z為S元素;Y的原子序數大于S,則Y為Cl元素;N是短周期主族元素中原子半徑最大的非金屬元素,則N為Si元素;Y的最高化合價與其最低化合價的代數和等于6,Y位于ⅦA族,其原子序數小于Si,則Y為F元素;M與X、Y既不同族,也不同周期,則M為H元素,據此分析解答。
根據上述分析可知:M為H元素,X為O元素,N為Si元素,Z為S元素,Y為Cl元素。
(1)X為O元素,名稱為氧;M為H,名稱為氫,故答案為:氧;氫;
(2)Cl的原子序數為17,位于周期表中第三周期ⅦA族;Z的氫化物為硫化氫,硫化氫為共價化合物,其電子式為![]() ,故答案為:第三周期ⅦA族;
,故答案為:第三周期ⅦA族;![]() ;
;
(3)N的氧化物為SiO2,SiO2與NaOH溶液反應生成硅酸鈉和水,該反應的化學方程式為SiO2+2NaOH=Na2SiO3+H2O,故答案為:SiO2+2NaOH=Na2SiO3+H2O;
(4)非金屬性越強,最高價氧化物對應水化物的酸性越強,非金屬性Cl>S,則最高價氧化物對應水化物的酸性:HClO4>H2SO4,故答案為:HClO4;H2SO4。


科目:高中化學 來源: 題型:
【題目】硫酸亞鐵銨(NH4)2Fe(SO4)26H2O又稱莫爾鹽,是淺綠色晶體。用硫鐵礦(主要含FeS2、SiO2等)制備莫爾鹽的流程如下:

已知:FeS2與H2SO4不反應。相應物質的溶解度曲線如下圖。
(1)FeS2中S元素的化合價為______。
(2)硫鐵礦焙燒的主反應是:4FeS2+11O2![]() 2Fe2O3+8SO2,加快硫鐵礦焙燒速率的措施有______(寫兩點即可)。
2Fe2O3+8SO2,加快硫鐵礦焙燒速率的措施有______(寫兩點即可)。
(3)加H2SO4酸浸,發生反應的離子方程式為______。
(4)“還原”時,Fe3+可通過反應Ⅰ、Ⅱ被FeS2還原。反應Ⅰ為:FeS2 +14Fe3+ +8H2O===15Fe2++ 2SO42—+16H+反應Ⅱ的離子方程式為:______。
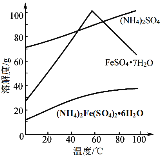
(5)得到莫爾鹽晶體的操作是:蒸發濃縮、結晶、過濾、洗滌。結晶、過濾時選擇的適宜溫度為60℃,解釋選擇該溫度的原因______。
(6)為證明所得莫爾鹽晶體中含有Fe2+和NH4+,實驗方法是取其少量溶液于一支試管中,______,證明含有Fe2+和NH4+。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,將0.1 mol/LNaOH溶液分別滴加到0.1 mol/LHA溶液和HB溶液中,兩混合溶液中離子濃度與pH的變化關系如圖所示,回答下列問題:

(1)請計算出Ka(HA) =_____,Ka(HB)_____ Ka(HA) (填“大于' “等于”或“小于”)。
(2)等濃度的HA和HB溶液,若要向其中之一加水讓二者pH值相等,應該向_____中加水。
(3)若分別向等濃度等體積的HA和HB溶液中加入NaOH固體讓二溶液都呈中性,則 ______需要的NaOH多。
(4)a點溶液中,水電離出的c(H+)=_______。b點溶液中,c(B-)____ c(Na+)(填“大于”、“等于”或“小于”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定溫度下,將氣體X和氣體Y各2 mol充入某10 L恒容密閉容器中,發生反應X(g)+Y(g) ![]() 2Z(g) △H<0,—段時間后達到平衡。反應過程中測定的數據如下表:
2Z(g) △H<0,—段時間后達到平衡。反應過程中測定的數據如下表:
t/min | 2 | 4 | 10 | 12 |
n(Y)/mol | 1.40 | 1.10 | 0.40 | 0.40 |
下列說法正確的是
A. 反應前2 min 的平均速率v(Z)=3.0xl0-2 mol L-1min-1
B. 該溫度下此反應的平衡常數K=64
C. 平衡后其他條件不變,再充入2 mol Z,新平衡時X的體積分數增大
D. 反應進行到10 min時保持其他條件不變,降低溫度,反應達到新平衡前v(逆)>v(正)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向lOmL 1 mol L-1的HCOOH溶液中不斷滴加1 mol L-1的NaOH溶液,并一直保持常溫,所加堿的體積與-lgc(H+)的關系如圖所示。c(H+)為溶液中水電離出的c(H+)。下列說法正確的是()

A. HCOOH為強電解質
B. a、b兩點pH均為7
C. 混合溶液的pH逐漸增大
D. 從a點到b點,溶液的導電性先增強后減弱
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學設計如下三個實驗方案,以探究某反應是放熱反應還是吸熱反應:

方案一:如圖1,在小燒杯里放一些除去氧化鋁保護膜的鋁片,然后向燒杯里加入10 mL 2 mol/L稀硫酸,再插入一支溫度計,溫度計的溫度由20 ℃逐漸升至75 ℃,隨后,溫度逐漸下降,最終停留在20 ℃。
方案二:如圖2,在燒杯底部用熔融的蠟燭粘一塊小木片,在燒杯里加入10 mL 2 mol/L硫酸溶液,再向其中加入氫氧化鈉溶液,片刻后提起燒杯,發現小木片脫落下來。
方案三:如圖3,甲試管中發生某化學反應,實驗前U形管紅墨水液面相平,在化學反應過程中,通過U形管兩側紅墨水液面高低判斷某反應是吸熱反應還是放熱反應。
序號 | 甲試管里發生反應的物質 | U形管里紅墨水液面 |
① | 氧化鈣與水 | 左低右高 |
② | 氫氧化鋇晶體與氯化銨晶體(充分攪拌) | ? |
③ | 鋁片與燒堿溶液 | 左低右高 |
④ | 銅與濃硝酸 | 左低右高 |
根據上述實驗回答相關問題:
(1)該鋁片與稀硫酸的反應是________(填“吸熱”或“放熱”)反應。
(2)方案二中,小木片脫落的原因是_________,由此得出的結論是________。
(3)由方案三的現象得出結論:①③④組物質發生的反應都是________(填“吸熱”或“放熱”)反應。
(4)方案三實驗②的U形管中的現象為___________,說明反應物的總能量小于生成物的總能量。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,反應N2(g)+3H2(g)![]() 2NH3(g)不能作為達到平衡狀態的依據的是
2NH3(g)不能作為達到平衡狀態的依據的是
A. N2,H2和NH3的質量分數不再改變
B. c(N2)∶c(H2)∶c(NH3)=1∶3∶2
C. 斷開1 mol H-H的同時形成1 mol H-H
D. 單位時間里每增加1 mol N2,同時消耗3 molH2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學研究小組探究外界條件對化學反應mA(g)+nB(g)![]() pC(g)的速率和平衡的影響,圖像如下,下列判斷正確的是( )
pC(g)的速率和平衡的影響,圖像如下,下列判斷正確的是( )

A. 由圖a可知,T1>T2,該反應的逆反應為吸熱反應
B. 由圖b可知,該反應m+n<p
C. 圖c是絕熱條件下速率和時間的圖像,由此說明該反應吸熱
D. 圖d中,若m+n=p,則曲線a一定增大了壓強
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氫鹵酸的能量關系如圖所示下列說法正確的是

A. 已知HF氣體溶于水放熱,則HF的△H1<0
B. 相同條件下,HCl的△H2比HBr的小
C. 相同條件下,HCl的△H3+△H4比HI的大
D. 一定條件下,氣態原子生成1molH-X鍵放出akJ能量,則該條件下△H2=+akJ/mol
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com