
【題目】有一鎂、鋁合金,在適量稀硫酸中恰好完全溶解,再加入氫氧化鈉溶液,析出沉淀的物質的量隨氫氧化鈉溶液的體積變化如圖所示,則合金中鎂、鋁的物質的量之比為( ) 
A.2:1
B.4:1
C.1:1
D.1:2
【答案】C
【解析】解:氫氧化鈉的體積為0~5時,生成沉淀,發生的反應有:Al3++3OH﹣═Al(OH)3↓,Mg2++2OH﹣═Mg(OH)2↓,氫氧化鈉的體積為5~6時沉淀部分溶解,發生的反應為:Al(OH)3+NaOH═NaAlO2+2H2O,
設氫氧化鈉的濃度為cmol/l,生成沉淀和沉淀溶解時用到的氫氧化鈉的物質的量為5cmol和cmol,沉淀部分溶解時:Al(OH)3+NaOH═NaAlO2+2H2O,n【Al(OH)3】=n(NaOH)=cmol,即氫氧化鋁的物質的量為cmol,生成沉淀時:Al3++3OH﹣═Al(OH)3↓,用到氫氧化鈉的物質的量為3n【Al(OH)3】=3cmol,生成沉淀時用到氫氧化鈉的物質的量為5cmol,其中的3mol生成氫氧化鋁,則有2cmolNaOH反應生成氫氧化鋁,由Mg++2OH﹣═Mg(OH)2↓知:n【Mg(OH)2】=cmol,由原子守恒知:Al~Al3+~Al(OH)3 , n(Al)=n【Al(OH)3】=cmol,Mg~Mg2+~Mg(OH)2 , n(Mg)=n【Mg(OH)2】=cmol,故合金中鎂、鋁的物質的量之比為1:1,
故選C.


科目:高中化學 來源: 題型:
【題目】水的電離平衡曲線如圖所示。下列說法中,正確的是

A. 圖中A、D、E三點處KW間的關系:E處>A處>D處
B. 溫度不變時,往水中通入適量HCl氣體,可以使水的電離從A點變化到D點
C. 溫度不變時,在水中加入適量CH3COONa固體,可以使水的電離從A點變化到C點
D. 在B點處,0.5 mol·L-1的H2SO4溶液與1 mol·L-1的KOH溶液等體積混合,充分反應后,所得溶液的pH=7
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫酸鐵銨[aFe2(SO4) 3·b(NH4) 2SO4·cH2O]廣泛用于城鎮生活飲用水、工業循環水的凈化處理等。某化工廠以硫酸亞鐵(含少量硝酸鈣)和硫酸銨為原料,設計了如下工藝流程制取硫酸鐵銨。

請回答下列問題:
(1)硫酸亞鐵溶液加H2SO4酸化的主要目的是_________,濾渣A的主要成分是________。
(2)下列物質中最適合的氧化劑B是______(填字母);反應的離子方程式___________。
a.NaClO b.H2O2 c.KMnO4 d.K2Cr2O7
(3)操作甲名稱分別是:甲______________,乙為常溫晾干。
(4)上述流程中,氧化之后和加熱蒸發之前,需取少量檢驗Fe2+是否已全部被氧化,所加試劑為__(寫化學式),能否用酸性的KMnO4溶液?_________填“能”或“否”)理由是:_______。(可用語言或方程式說明)
(5)稱取14.00 g樣品,將其溶于水配制成100 mL溶液,分成兩等份,向其中一份中加入足量NaOH溶液,過濾洗滌得到2.14 g沉淀;向另一份溶液中加入0.05 mol Ba(NO3)2溶液,恰好完全反應。則該硫酸鐵銨的化學式為______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將11.2L標準狀況下的甲烷和某單烯羥的混合氣體通入足量的溴的四氯化碳溶液中充分反應,溴的四氯化碳溶液增加了12.6g.該烯羥對氫氣的相對密度為21(相對密度 ![]() )
)
①試確定該烯烴;
②求原混合氣體中甲烷與烯烴的物質的量之比以及質量之比.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式正確的是( )
A.鈉投入到水中 2Na+2H2O═2Na++2OH﹣+H2↑
B.氯化銨溶液與濃NaOH溶液加熱 NH4++OH﹣═NH3H2O
C.氯化鋁溶液中滴入過量氨水 Al3++3NH3H2O═Al(OH)3↓+3NH4+
D.鐵片插入氯化鐵溶液中 Fe+Fe3+═2Fe2+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】等質量的CH4和NH3相比較,下列結論錯誤的是
A. 它們的分子個數比為17:16 B. 它們的原子個數比為17:16
C. 它們的氫原子個數比為17:12 D. 它們所含氫元素的質量比為17:12
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】選用適當的試劑和除雜方法除去下列各物質中的雜質(括號中為雜質),將所選試劑和操作的名稱填寫在表格中.
序號 | 物質 | 試劑 | 除雜方法 |
① | 甲烷(C2H4) | ||
② | 硝基苯(混合酸) | ||
③ | KNO3(NaCl) |
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】亞硝酸鈉常用作食品防腐劑。現用下圖所示儀器(夾持裝置已省略)及藥品。探究亞硝酸鈉與硫酸的反應及生成氣體產物的成分。巳知氣體液化的溫度:NO2:21℃;NO:-152 ℃
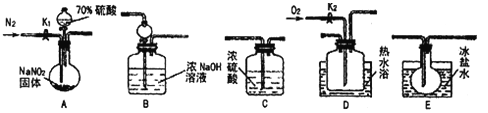
回答下列問題:
(1)為了檢驗裝置A中生成的氣體產物,儀器的連接順序為(按從左到右連接): A→C→___→____→______。
(2)組裝好儀器后,接下來進行的操作是____;實驗開始時通入N2的作用是______.
(3)關閉彈贊夾K1,打開分液漏斗活塞,滴入70%硫酸后,A中產生紅棕色氣體。確認A中產生的氣體中含有NO,依據的現象是__________;裝置E的作用是__________。
(4)根據上述實驗,寫出該反應的化學方程式:__________。
如果沒有裝置C,對驗證結論造成的影響是__________。
(5)實驗結束后還需通入N2的作用是_______;如果向D中通入過量O2,則裝置B中發生反應的離子方程式為_____________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com