
分析 (1)①高溫時,鋁與二氧化錳發生置換反應生成錳,為鋁熱反應;
②根據提供的反應物和產物及氧化還原反應可知Mn由+4價變為+2價,氧元素化合價肯定升高;
(2)Fe在氯氣中燃燒生成氯化鐵,取少量X溶液兩份,一份加入KSCN溶液時,溶液顯紅色,則X中含Fe3+,另一份中加入黃色鐵氰化鉀 (K3[Fe(CN)6])溶液后能發生復分解反應生成藍色沉淀,則X中還含具有還原性的Fe2+,即Fe與氯氣的反應中Fe過量,以此解答;
(3)15.6gNa2O2的物質的量為$\frac{15.6g}{78g/mol}$=0.2mol,5.4gAl的物質的量為$\frac{5.4g}{27g/mol}$=0.2mol,6.72LHCl氣體的物質的量為$\frac{6.72L}{22.4L/mol}$=0.3mol;先計算過氧化鈉、鋁及HCl的物質的量,再利用發生的化學反應:2Na2O2+2H2O═4NaOH+O2↑、2Al+2NaOH+2H2O═2NaAlO2+3H2↑、NaOH+HCl═NaCl+H2O、NaAlO2+HCl+H2O═Al(OH)3↓+NaCl來分析解答.
解答 解:(1)①高溫時,鋁與二氧化錳發生置換反應生成錳,反應的方程式為3MnO2+4Al$\frac{\underline{\;高溫\;}}{\;}$3Mn+2Al2O3,
故答案為:3MnO2+4Al$\frac{\underline{\;高溫\;}}{\;}$3Mn+2Al2O3;
②根據氧化還原反應可知Mn由+4價變為+2價,氧化合價肯定升高,所以產物有氧氣生成,反應為MnO2+H2O2+2H+═Mn2++O2↑+2H2O,
故答案為:MnO2+H2O2+2H+═Mn2++O2↑+2H2O;
(2)Fe在氯氣中燃燒生成氯化鐵,取少量X溶液兩份,一份加入KSCN溶液時,溶液顯紅色,則X中含Fe3+,另一份中加入黃色鐵氰化鉀 (K3[Fe(CN)6])溶液后能發生復分解反應生成藍色沉淀,則X中還含具有還原性的Fe2+,即Fe與氯氣的反應中Fe過量,
①由上述分析可知,X中含金屬離子為Fe3+、Fe2+,發生的反應有:2Fe+Cl2$\frac{\underline{\;點燃\;}}{\;}$2FeCl3、2FeCl3+Fe=3FeCl2,
故答案為:2Fe+Cl2$\frac{\underline{\;點燃\;}}{\;}$2FeCl3、2FeCl3+Fe=3FeCl2;
②藍色沉淀是由鐵氰化鉀與低價態陽離子反應的結果,低價陽離子為亞鐵離子,則反應的離子方程式為:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓,
故答案為:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓;
(3)15.6gNa2O2的物質的量為$\frac{15.6g}{78g/mol}$=0.2mol,5.4gAl的物質的量為$\frac{5.4g}{27g/mol}$=0.2mol,6.72LHCl氣體的物質的量為$\frac{6.72L}{22.4L/mol}$=0.3mol,
2Na2O2+2H2O═4NaOH+O2↑
0.2mol 0.4mol 2.24L
2Al+2H2O+2NaOH═2NaAlO2+3H2↑
0.2mol 0.2mol 0.2mol 6.72L
顯然氫氧化鈉過量,鋁完全反應,
①反應中共得到氣體的體積為:2.24L+6.72L=8.96L,
故答案為:8.96L;
②將15.6gNa2O2和5.4gAl同時放入一定量的水中,反應后溶液的成分為0.2molNaOH和0.2molNaAlO2,加入0.3molHCl,0.2mol氫氧化鈉消耗0.2mol氯化氫,剩余的0.1mol氯化氫與偏鋁酸鈉反應NaAlO2+HCl+H2O═Al(OH)3↓+NaCl生成0.1mol氫氧化鋁沉淀,
生成的氫氧化鋁的質量為:78g/mol×0.1mol=7.8g,
故答案為:是;7.8g.
點評 本題考查了金屬及其化合物性質的綜合應用、離子方程式的計算,題目難度中等,試題知識點較多、綜合性較強,充分考查了學生的分析、理解能力及化學計算能力,注意掌握常見金屬單質及其化合物性質,能夠根據根據發生的反應完成相關計算.


 能考試期末沖刺卷系列答案
能考試期末沖刺卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | 以煤、石油和天然氣為主要原料生產的合成材料是塑料、合成橡膠、合成纖維 | |
| B. | 煤是工業上獲得芳香烴的一種重要來源 | |
| C. | 石油的裂解是為了提高輕質油(例如汽油)的產量 | |
| D. | 天然氣的主要成分是甲烷,屬于不可再生資源 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 離子化合物一定含有離子鍵 | |
| B. | 共價化合物一定不含離子鍵 | |
| C. | 只含共價鍵的物質叫共價化合物 | |
| D. | 化學反應的過程,本質上是舊化學鍵斷裂和新化學鍵形成的過程 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
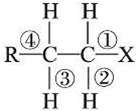
| A. | 發生水解反應時,被破壞的鍵是①和③ | |
| B. | 發生消去反應時,被破壞的鍵是①和③ | |
| C. | 發生水解反應時,被破壞的鍵是①和④ | |
| D. | 發生消去反應時,被破壞的鍵是①和② |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 達到化學平衡時,速率關系為:v(NH3):v(O2):v(NO):v(H2O)=4:5:4:6 | |
| B. | 若單位時間內生成x mol NO的同時,消耗x mol NH3,則反應達平衡狀態 | |
| C. | 達到化學平衡時,若增加體積,則正反應速率減小,逆反應速率增大 | |
| D. | 達到化學平衡時v正(O2):v逆(NO)=5:4 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 物質 | 雜質 | 選用試劑 | 化學方程式 |
| FeCl2溶液 | FeCl3 | 鐵粉 | Fe+2FeCl3=3FeCl2 |
| SiO2 | Al 2O3 | 鹽酸 | Al2O3+6HCl=2AlCl3+3H2O |
| Fe(OH)3 | Al(OH)3 | NaOH溶液 | Al(OH)3+NaOH=Na[Ai(OH)4] |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com