
【題目】甲醇是重要的綠色能源之一,目前科學家用水煤氣(CO+H2)合成甲醇,其反應為:CO(g)+2H2(g) ![]() CH3OH(g),△H=﹣128.1kJmol﹣1 , 回答下列問題:
CH3OH(g),△H=﹣128.1kJmol﹣1 , 回答下列問題:
(1)該反應是可逆反應,為使化學反應速率和CO的轉化率都同時提高的措施有(寫兩條).
(2)恒溫恒容條件能說明該可逆反應達平衡的是;
A.2v正(H2)=v逆(CH3OH)
B.n(CO):n(H2):n(CH3OH)=1:2:1
C.混合氣體的密度不變
D.混合氣體的平均相對分子質量不變
(3)若上述可逆反應在恒溫恒容的密閉容器進行,起始時間向該容器中沖入1molCO(g)和2molH2(g).實驗測得H2的平衡轉化率隨溫度(T)、壓強(P)的變化如圖所示.
①該反應的△S0,圖中的T1T2(填“<”“>”或“=”)
②T1下到達平衡狀態A時,容器的體積為2L,此時該反應的平衡常數為 , 若達到平衡狀態B時,則容器的體積V(B)=L.
(4)已知:H2(g)燃燒熱△H=﹣285.8KJmol﹣1、和CO(g)燃燒熱△H=﹣283.0KJmol﹣1 , 則CH3OH(g)燃燒熱的熱化學方程式是為 .
【答案】
(1)增大壓強、增加氫氣的物質的量
(2)D
(3)<,<,4L2/mol2,0.4
(4)![]() △H=﹣726.5kJ/mol
△H=﹣726.5kJ/mol
【解析】解:(1)該反應式可逆反應,隨著反應的進行,氣體分子總數減小,體系壓強減小,反應焓變<0,表明反應是放熱反應,為了使化學反應速率和CO的轉化率同時提高,根據勒夏特列原理,可以考慮采取的措施有增大壓強,增加氫氣的物質的量.所以答案是:增大壓強、增加氫氣的物質的量.(2)恒溫恒容條件下,常用判斷化學反應達到平衡的判據有正逆反應速率,熱量變化情況,體系有氣體參與時的壓強變化等.
A.能判定化學反應達到平衡的速率關系應為v正(H2)=2v逆(CH3OH),故A錯誤;
B.當反應物按照化學計量比1:2反應,到達平衡時,各組分的物質的量之比需視具體的轉化率而定,n(CO):n(H2):n(CH3OH)=1:2:1不可作為判據,故B錯誤;
C.混合氣體的密度為 ![]() ,在恒溫恒容密閉體系中,根據質量守恒定律,m混是不變的,整個反應過程混合氣體的密度是不變的,不可作為判據,股C錯誤;
,在恒溫恒容密閉體系中,根據質量守恒定律,m混是不變的,整個反應過程混合氣體的密度是不變的,不可作為判據,股C錯誤;
D.混合氣體的平均相對分子質量為 ![]() ,由于化學反應前后,氣體的物質的量在改變,則混合氣體的平均相對分子質量隨著反應的進行將發生改變直到反應達到平衡,可以作為判據,故D正確.
,由于化學反應前后,氣體的物質的量在改變,則混合氣體的平均相對分子質量隨著反應的進行將發生改變直到反應達到平衡,可以作為判據,故D正確.
故選D.(3)①反應在恒溫恒容密閉容器中進行,起始時向容器中沖入1molCO(g)和2molH2(g),實驗測得H2的平衡轉化率隨溫度(T)和壓強(p)的變化有圖,根據圖象,隨著該反應的進行,體系總壓強減小,氣體分子數減小,反應是熵減的反應,即體系的混亂度減小,故△S<0;控制壓強不變,發現T1溫度下的H2轉化率更高,結合反應是放熱的反應(△H<0)可知,溫度減小有利于反應物的轉化率提高,故T1<T2.所以答案是:<,<.
②T1下達平衡狀態A時,根據圖象可知,此時體系壓強為p1,H2轉化率為0.5,已知容器的體積為2L,則平衡時,根據反應方程式:CO(g)+2H2(g)CH3OH(g),由于氫氣的轉化率為0.5,則氫氣轉化了△n(H2)=2mol×0.5=1mol,則CO轉化了△n(CO)=0.5mol,生成了CH3OH為△n(CH3OH)=0.5mol,因此平衡時 ![]() ,
, ![]() ,
, ![]() ,根據平衡常數的表達式
,根據平衡常數的表達式 ![]() =
= ![]() =4L2/mol2.
=4L2/mol2.
當反應達到平衡狀態B時,根據圖象,此時壓強為p2,氫氣的轉化率為0.8,此時氫氣轉化了△n(H2)=2mol×0.8=1.6mol,根據反應方程式,CO轉化了△n(CO)=0.8mol,生成了CH3OH為△n(CH3OH)=0.8mol,設此時容器體積為VL,則平衡時 ![]() mol/L,
mol/L, ![]() mol/L,
mol/L, ![]() mol/L,B狀態溫度也為T1,反應平衡常數仍為K=4L2/mol2,則
mol/L,B狀態溫度也為T1,反應平衡常數仍為K=4L2/mol2,則  =4L2/mol2,解得V(B)=0.4L.
=4L2/mol2,解得V(B)=0.4L.
所以答案是4L2/mol2,0.4.(4)反應的焓變=反應物的總燃燒熱﹣生成物的總燃燒熱,已知H2的燃燒熱為△H(H2)=﹣285.8kJ/mol,CO的燃燒熱為△H(CO)=﹣283.0kJ/mol,反應CO(g)+2H2(g)=CH3OH(g),該反應的焓變為△H=△H(CO)+2△H(H2)﹣△H(CH3OH,g)=﹣128.1kJ/mol,解得△H(CH3OH,g)=﹣726.5kJ/mol,則CH3OH(g)的燃燒熱的熱化學方程式為: ![]() ═CO2(g)+2H2O(l)△H=﹣726.5kJ/mol.
═CO2(g)+2H2O(l)△H=﹣726.5kJ/mol.
所以答案是: ![]() ═CO2(g)+2H2O(l)△H=﹣726.5kJ/mol.
═CO2(g)+2H2O(l)△H=﹣726.5kJ/mol.
【考點精析】利用化學平衡狀態本質及特征和化學平衡狀態的判斷對題目進行判斷即可得到答案,需要熟知化學平衡狀態的特征:“等”即 V正=V逆>0;“動”即是動態平衡,平衡時反應仍在進行;“定”即反應混合物中各組分百分含量不變;“變”即條件改變,平衡被打破,并在新的條件下建立新的化學平衡;與途徑無關,外界條件不變,可逆反應無論是從正反應開始,還是從逆反應開始,都可建立同一平衡狀態(等效);狀態判斷:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不變④若A、B、C、D為氣體,且m+n≠x+y,壓強恒定⑤體系顏色不變⑥單位時間內某物質內化學鍵的斷裂量等于形成量⑦體系平均式量恒定(m+n ≠ x+y)等.


科目:高中化學 來源: 題型:
【題目】溴苯是一種化工原料,實驗室合成溴苯的裝置示意圖及有關數據如下:
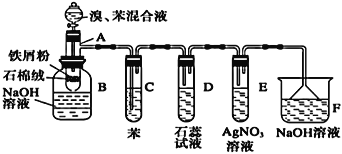
(A為具有支管的試管,在其下端開了一個小孔。塞好石棉絨。再加入少量鐵屑粉)
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸點/℃ | 80 | 59 | 156 |
水溶性 | 微溶 | 微溶 | 微溶 |
填寫下列空白:
(1)向反應容器A中逐滴加入溴和苯的混合液,幾秒鐘內就發生反應。寫出A中有機物發生的反應方程式(有機物寫結構簡式):______________________,反應類型為______________。
(2)反應開始后,可觀察到D中溶液變紅,E中出現__________________,試管C中苯的作用是__________。用相關化學用語解釋D中溶液變紅的原因________________。
(3)反應2~3min后,在B中可觀察到在溶液中出現紅色絮狀沉淀、底部有油狀液體。生成紅色絮狀沉淀的離子方程式為_______________________________。
(4)向B中分離出的油狀液體加入少量無水氯化鈣,靜置、過濾。加入氯化鈣的目的是________________。
(5)經以上分離操作后,粗溴苯中還含有的主要雜質為______,要進一步提純,下列操作中必需的是______(填入正確選項前的字母)。
A.蒸發 B.過濾 C.蒸餾 D.萃取
(6)在A~F中,具有防倒吸作用的有_________(填字母)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】“忽聞海上有仙山,山在虛無縹緲間。”海市蜃樓是一種自然現象,發生這種現象的本質原因是( )
A. 人產生的視幻覺,無法解釋
B. 空氣中的小液滴顆粒直徑為100納米以上
C. 此時空氣是膠體,產生了丁達爾效應
D. 光本身是一種膠體,在空氣中被反射到了觀察者的眼內
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用如圖裝置制取、提純并收集下表中的四種氣體(a、b、c、d表示相應儀器中加入的試劑,收集裝置略去).其中可行的是( )
氣體 | a | b | c | d | |
A | CO2 | 稀硫酸 | 石灰石 | 飽和Na2CO3溶液 | 濃H2SO4 |
B | Cl2 | 濃鹽酸 | KMnO4固體 | 飽和NaCl溶液 | 濃H2SO4 |
C | NH3 | 飽和NH4Cl溶液 | 消石灰 | H2O | 堿石灰 |
D | H2 | 硝酸 | 鋅粒 | H2O | P2O5 |

A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】圖1是元素周期表的一部分,A、B、C、D、E、X 是元素周期表給出元素組成的常見單質或化合物.已知 A、B、C、D、E、X 存在如圖2所示轉化關系(部分生成物和反應條件略去). 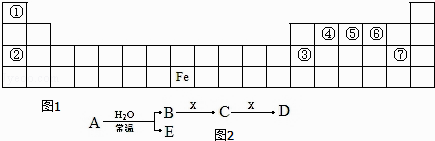
(1)若 E 為氧化物,則 A 與水反應的方程式為 , 該反應中氧化劑和還原劑物的量之比為 . ①當 X 為堿性鹽溶液,C分子中有 22 個電子時,D 是(寫化學式).
②當 X 為金屬單質時,X 與足量 B 的稀溶液反應生成 C 的離子方程式為 , 寫出檢驗生成物 C 的陽離子所用試劑的電子式 .
(2)若 E 為單質氣體,D 為白色沉淀,A 可能是(寫化學式),X是(寫化學式).
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在甲、乙兩燒杯溶液中,分別含有大量Cu2+、K+、H+、Cl﹣、CO32﹣、OH﹣6種離子中的3種,已知甲燒杯的溶液呈藍色,則乙燒杯溶液中大量存在的離子是
A. K+、OH﹣、CO32﹣ B. CO32﹣、OH﹣、Cl﹣
C. K+、H+、Cl﹣ D. Cu2+、H+、Cl﹣
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】元素O、N可分別與H形成多種電子數為10的微粒,如H2O、H3O+、OH-、NH3、NH4+、NH2-等,下列有關說法正確的是
A. 原子或簡單離子半徑:N均大于O B. OH-和NH2-的質子數、中子數均相等
C. H3O+的電子式為![]() D. NH3和NH4+均能使濕潤的紅色石蕊試紙變藍
D. NH3和NH4+均能使濕潤的紅色石蕊試紙變藍
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com