
【題目】某化學課外興趣小組探究銅與濃硫酸的反應情況.甲.乙.丙三位同學進行了下列實驗:取12.8g銅片和20ml.18mol/L的濃硫酸放在圓底燒瓶中共熱,直至反應完畢,最后發現燒瓶中還有銅片剩余外,同時根據所學的知識認為還有較多的硫酸剩余.
(1)請寫出銅跟濃硫酸反應的化學方程式: ,
試問:為什么較多的余酸不再與銅片繼續反應?簡述理由: .
可以證明有余酸的實驗方案是 (填寫字母,錯選或多選扣分).
a.再加入鐵粉 b.再滴入BaCl2溶液
c.再加入銀 d.再滴入Na2CO3溶液
(2)甲學生設計求余酸濃度的實驗方案是測定產生氣體的量.其方法有多種,請問下列方案中不可行的是 (填寫字母,錯選或多選扣分).
a.將產生的氣體緩緩通過預先稱量盛有堿石灰的干燥管,結束反應后再次稱量.
b.將產生的氣體緩緩通入酸性高錳酸鉀溶液,再加入足量BaCl2溶液,過濾、洗滌、干燥、稱量沉淀.
c.用排水法測定其產生氣體的體積(折算成標準狀況).
d.用排飽和NaHSO3溶液的方法測出其產生氣體的體積(折算成標準狀況).
(3)乙同學設計測定余酸濃度的實驗方案是:測定反應后的混合液中Cu2+的量.在反應后的溶液中加蒸餾水稀釋至100ml,加入足量Na2S溶液,充分反應后,過濾.洗滌.干燥、稱量沉淀.請寫出生成沉淀的離子方程式: .
(4)根據甲、乙兩同學的實驗方案,除測算產生氣體的物質的量或反應掉的銅的物質的量外,尚缺少的測量數據是 .
(5)丙同學提出甲、乙兩同學的實驗方案設計的復雜,為此他設計了下列較為簡易的實驗方案:取出反應后的銅片,進行洗滌.干燥.稱量.若稱得剩余銅片的質量為Wg,測得反應后溶液的體積為Vml,請計算剩余硫酸的物質的量濃度= mol/L(用含W.V的代數式表示)
【答案】(1)Cu+2H2SO4(濃)![]() CuSO4+2H2O+SO2↑;銅片過量,硫酸反應后溶液變稀不支持反應;
CuSO4+2H2O+SO2↑;銅片過量,硫酸反應后溶液變稀不支持反應;
ad;(2)ac;(3)Cu2++S2﹣=CuS↓;(4)反應后溶液的體積;(5)![]() .
.
【解析】
試題分析:(1)濃硫酸有強氧化性,可將銅氧化;稀硫酸無強氧化性,不能以銅反應;根據金屬的通性,
氫離子能與活潑金屬如鐵反應,若有氫氣生成,則說明有余酸;即使沒有余酸溶液中也有硫酸根,都能與氯化鋇反應生成沉淀;稀硫酸與銀不反應;氫離子能與碳酸鹽反應,若有能使澄清的石灰水變渾濁的氣體生成,則說明有余酸;(2)堿石灰能吸收二氧化硫和水,故不能測出二氧化硫的質量;二氧化硫易溶于水,不能用排水法測體積;(3)Cu2+與S2﹣反應生成黑色沉淀;(4)物質的量濃度等于溶液中溶質的物質的量物質的量除以溶液的體積,缺少溶液的體積;(5)反應的銅的物質的量=
![]() ,反應掉的硫酸的物質的量是銅的二倍,為
,反應掉的硫酸的物質的量是銅的二倍,為![]() ,用總的硫酸的物質的量減去反應的就是剩余的,為0.36﹣
,用總的硫酸的物質的量減去反應的就是剩余的,為0.36﹣![]() ,然后根據物質的量濃度等于溶液中溶質的物質的量物質的量除以溶液的體積即可求出.
,然后根據物質的量濃度等于溶液中溶質的物質的量物質的量除以溶液的體積即可求出.


科目:高中化學 來源: 題型:
【題目】將7g某Cu、Ag合金與一定量的濃硝酸反應,合金完全溶解后放出的氣體與標準狀況下0.56L氧氣混合后,通入水中恰好完全被吸收,則合金中銅的質量為
A. 1.6g B. 2.4g C. 3.2g D. 4.8g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為了有效控制霧霾,各地積極采取措施改善大氣質量,研究并有效控制空氣中的氮氧化物含量、使用清潔能源顯得尤為重要。
(1)已知:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) H = -905.48 kJ·mol-1
4NO(g)+6H2O(g) H = -905.48 kJ·mol-1
N2(g)+O2(g)![]() 2NO(g) H = +180.50 kJ·mol-1
2NO(g) H = +180.50 kJ·mol-1
則4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g)的H = 。
5N2(g)+6H2O(g)的H = 。
(2)某化學小組查閱資料知2NO(g)+O2(g)![]() 2NO2(g)的反應歷程分兩步:
2NO2(g)的反應歷程分兩步:
第一步:2NO(g)![]() N2O2(g) (快) H1<0 v1正=k1正c2(NO) ;v1逆=k1逆c(N2O2)
N2O2(g) (快) H1<0 v1正=k1正c2(NO) ;v1逆=k1逆c(N2O2)
第二步:N2O2(g)+O2(g)![]() 2NO2(g) (慢) H2< 0
2NO2(g) (慢) H2< 0
v2正=k2正c(N2O2)c(O2);v2逆=k2逆c2(NO2)
① 2NO(g)+O2(g)![]() 2NO2(g)的反應速率主要是由_______(填“第一步”或“第二步”)反應決定。
2NO2(g)的反應速率主要是由_______(填“第一步”或“第二步”)反應決定。
② 一定溫度下,反應2NO(g)+O2(g)![]() 2NO2(g)達到平衡狀態,請寫出用k1正、k1逆、k2正、k2逆表示的平衡常數表達式K= ;升高溫度,K值 (填“增大”、“減 小”或“不變”)
2NO2(g)達到平衡狀態,請寫出用k1正、k1逆、k2正、k2逆表示的平衡常數表達式K= ;升高溫度,K值 (填“增大”、“減 小”或“不變”)
(3)利用活性炭涂層排氣管處理NOx的反應為:xC(s)+2NOx(g)![]() N2(g)+xCO2(g) △H <0;理論上,適當增加汽車排氣管(內壁為活性炭涂層)長度______(填“能”或“不能”)使NOx更加有效地轉化為無毒尾氣而排放,其原因是 。
N2(g)+xCO2(g) △H <0;理論上,適當增加汽車排氣管(內壁為活性炭涂層)長度______(填“能”或“不能”)使NOx更加有效地轉化為無毒尾氣而排放,其原因是 。
(4)一定量的CO2與足量的碳在體積可變的恒壓密閉容器中反應: C(s)+CO2(g)![]() 2CO(g)。平衡時,體系中氣體體積分數與溫度的關系如圖所示,則800℃時,反應達平衡時CO2的轉化率為________(保留一位小數)。
2CO(g)。平衡時,體系中氣體體積分數與溫度的關系如圖所示,則800℃時,反應達平衡時CO2的轉化率為________(保留一位小數)。

(5)氫氣是一種重要的清潔能源,Mg2Cu是一種儲氫合金。350℃時,Mg2Cu與H2反應,生成MgCu2和僅含一種金屬元素的氫化物(其中氫的質量分數為0.077)。Mg2Cu與H2反應的化學方程式為 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知W、X、Y、Z為短周期元素,原子序數依次增大。W、Z同主族,X、Y、Z
同周期,其中只有X為金屬元素。下列說法一定正確的是
A.原子半徑:X>Y>Z>W
B.W的含氧酸的酸性比Z的含氧酸的酸性強
C.W的氣態氫化物的穩定性小于Y的氣態氫化物的穩定性
D.若W與X原子序數差為5,則形成化合物的化學式為X3W2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中,錯誤的是
A.蔗糖、淀粉、纖維素水解的最終產物都只是葡萄糖
B.誤服重金屬鹽,立即服用牛奶或豆漿可解毒
C.油脂、乙酸乙酯都屬于酯類,但不是同系物
D.煤的干餾可以得到苯、甲苯等芳香烴
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學與社會、生活、環境保護密切相關,下列現象或事實與解釋一致的是
編號 | 現象或事實 | 解釋 |
A | SiO2+Na2CO3 | 酸性:H2SiO3>H2CO3 |
B | 2Mg+CO2 | 還原性:Mg>C |
C | 漂白粉因在空氣中放置時間過久而變質 | 漂白粉中的CaCl2與空氣中的CO2反應生成碳酸鈣 |
D | 利用氯化鐵溶液可以制作銅質印刷線路板 | FeCl3溶液置換出銅單質 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將4 mol A氣體和2 mol B氣體在2 L的容器中混合,并在一定條件下發生如下反應:2A(g)+B(g)![]() 2C(g)。經2 s后測得C的濃度為0.6 mol·L-1,現有下列幾種說法:
2C(g)。經2 s后測得C的濃度為0.6 mol·L-1,現有下列幾種說法:
①用物質A表示的反應的平均速率為0.3 mol·L-1·s-1
②用物質B表示的反應的平均速率為0.6 mol·L-1·s-1
③2 s時物質A的轉化率為70%
④2 s時物質B的濃度為0.7 mol·L-1。其中正確的是
A.①③ B.①④ C.②③ D.③④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】控制適合的條件,將反應2Fe3++2I-![]() 2Fe2++I2設計成如圖所示的原電池。下列判斷不正確的是( )
2Fe2++I2設計成如圖所示的原電池。下列判斷不正確的是( )
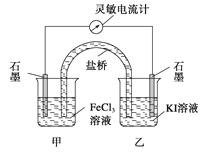
A.反應開始時,乙中石墨電極上發生氧化反應
B.反應開始時,甲中石墨電極上的Fe3+被還原
C.電流計讀數為零時,反應達到化學平衡狀態
D.電流計讀數為零后,在甲中溶入FeCl2固體,乙中的石墨電極為負極
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】【選修5:有機化學基礎】化合物E是一種醫藥中間體,常用于制備抗凝血藥,可以通過下圖所示的路線合成:

(1)E中的含氧官能團名稱為 。
(2)B轉化為C的反應類型是 。
(3)寫出D與足量NaOH溶液完全反應的化學方程式 。
(4)1molE最多可與 molH2加成。
(5)寫出同時滿足下列條件的B的一種同分異構體的結構簡式 。
A.苯環上只有兩個取代基,且除苯環外無其他環狀結構
B.核磁共振氫譜只有4個峰
C.能與FeCl3溶液發生顯色反應
(6)已知:酚羥基一般不易直接與羧酸酯化,甲苯可被酸性高錳酸鉀溶液氧化為苯甲酸。試參照如下和成路線圖示例寫出以苯酚、甲苯為原料制取苯甲酸苯酚酯(![]() )的合成路線(無機原料任選)。合成路線流程圖示例如下:
)的合成路線(無機原料任選)。合成路線流程圖示例如下:![]()
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com