
工業上用菱錳礦(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等雜質]為原料制取KMnO4。其流程示意圖如下:
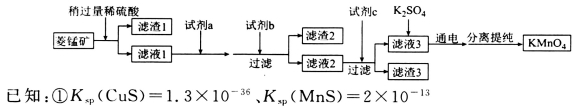
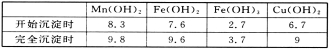
②金屬陽離子生成氫氧化物沉淀的pH如下表:
回答下列問題:
(1)寫出濾渣1的一種工業用途:_________________________________。實驗室模擬該流程過程中,洗滌濾渣1的具體操作方法為_______________________________________。
(2)試劑a最好選用________(填選項字母)。
A.氯水 B.高錳酸鉀 C.次氯酸鈉 D.濃鹽酸
(3)試劑b可選用______(填選項字母)。
A.氨水 B.稀硫酸 C.碳酸錳 D.Mn(OH)2 E.NaOH
(4)試劑c為MnS,寫出濾液2中加入MnS后發生反應的離子方程式:________________________。
(5)用惰性電極電解硫酸錳和硫酸鉀混合溶液的方法可以制取高錳酸鉀,寫出電解時的陽極反應式:__________________。工業上用硫酸溶解碳酸錳,而不用鹽酸溶解,其原因是_______________。
(6)KMnO4是一種常用的滴定試劑,某同學用酸性高錳酸鉀溶液測定濾液1中Fe2+的含量。滴定過程中,每次均量取25.00 mL的濾液1置于錐形瓶中,滴定三次平均消耗掉0.1000 mol/L的KMnO4溶液20.00 mL,則濾液1中Fe2+的濃度為______g/L(保留三位有效數字)。
科目:高中化學 來源:2015-2016學年江西吉安一中高二下第二次段考化學試卷(解析版) 題型:推斷題
已知:
RCHO+CH2(COOH)2  RCH=C(COOH)2+H2O
RCH=C(COOH)2+H2O
RCH=C(COOH)2  RCH=CHCOOH+CO2↑
RCH=CHCOOH+CO2↑
A與芳香族化合物B在一定條件下反生成C,進一步反應生成抗氧化劑阿魏酸(見圖)
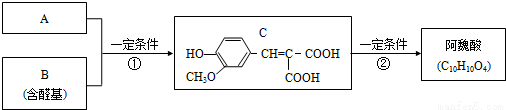
A的相對分子質量是104,1molA與足量NaHCO3溶液反應生成2mol氣體;
(1)A的結構簡式是_____________________;
(2)在中學學過知識里 B不可能發生的反應是__________(填序號)
a、取代反應 b、加成反應c、氧化反應d、還原反應e、水解反應 f、顯色反應
(3)等物質的量C分別與足量的Na、濃溴水、NaOH、NaHCO3反應時消耗Na、Br2、NaOH、NaHCO3的物質的量之比是__________________;
(4)寫出C與足量的Na2CO3的化學方程式為:_________________;
(5)寫出符合下列條件的阿魏酸所有的同分異構體的結構簡式_________________;
①在苯環上只有兩個取代基;
②在苯環上的一氯取代物只有兩種;
③1mol該同分異構體與足量NaHCO3反應生成2molCO2氣體;
④該同分異構體進行核磁共振氫譜分析發現只有4種峰
查看答案和解析>>
科目:高中化學 來源:2016屆遼寧省高三下第四次模擬理綜化學試卷(解析版) 題型:填空題
【化學---選修3:物質結構與性質】原子序數小于36的X、Y、Z、W四種元素,其中X是半徑最小的元素,Y原子基態時最外層電子數是其內層電子總數的2倍,Z原子基態時2p原子軌道上有3個未成對的電子,W原子4s原子軌道上有1個電子,M能層為全充滿的飽和結構。回答下列問題:

(1)W基態原子的價電子排布式____________;Y2X2分子中Y原子軌道的雜化類型為______。
(2)化合物ZX3的沸點比化合物YX4的高,其主要原因是_____________。
(3)元素Y的一種氧化物與元素Z的一種氧化物互為等電子體,元素Z的這種氧化物的分子式是____________。Y60用做比金屬及其合金更為有效的新型吸氫材料,其分子結構為球形32面體,它是由60個Y原子以20個六元環和12個五元環連接而成的具有30個Y=Y鍵的足球狀空心對稱分子。則該分子中σ鍵和π鍵的個數比_____;36gY60最多可以吸收標準狀況下的氫氣_____L。
(4)元素W的一種氯化物晶體的晶胞結構如右圖所示,該氯化物的化學式是___________,該晶體中W的配位數為___________。它可與濃鹽酸發生非氧化還原反應,生成配合物HnWCl3,反應的化學方程式為_________。
查看答案和解析>>
科目:高中化學 來源:2016屆湖北省黃岡市高三4月考試理綜化學試卷(解析版) 題型:實驗題
苯胺為無色液體,還原性強,易被氧化;有堿性,與酸反應生成鹽。常用硝基苯與H2制備: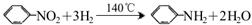 。
。
其部分裝置及有關數據如下:
沸點/℃ | 密度g/mL | 溶解性 | |
硝基苯 | 210.9 | 1.20 | 不溶于水,易溶于乙醇、乙醚 |
苯胺 | 184.4 | 1.02 | 微溶于水,易溶于乙醇、乙醚 |
乙醚 | 34.6 | 0.71 | 不溶于水,易溶于硝基苯、苯胺 |
實驗步驟:
①檢查裝置的氣密性,連接好C處冷凝裝置的冷水。
②先向三頸燒瓶中加入沸石及硝基苯,再取下恒壓分液漏斗,換上溫度計。
③打開裝置A、B間活塞,通入H2一段時間。
④點燃B處的酒精燈,加熱,使溫度維持在140℃進行反應。
⑤反應結束后,關閉裝置A、B間活塞,加入生石灰。
⑥調整好溫度計的位置,繼續加熱,收集182~186℃餾分,得到較純苯胺。
回答下列問題:
(1)步驟⑥中溫度計水銀球的位置在__________。
(2)下列關于實驗的敘述中,錯誤的是__________。
A.冷凝管的冷水應該從b進從a出
B.實驗開始酎,溫度計水銀球應插入反應液中,便于控制反應液的溫度
C.裝置A中應使用鋅粉,有利于加快生成H2的速率
D.加入沸石的目的是防止暴沸
(3)若實驗中步驟③和④的順序顛倒,則實驗中可能產生的后果是_____________。
(4)蒸餾前,步驟⑤中加入生石灰的作用是____________________。
(5)有學生質疑反應完成后,直接蒸餾得到苯胺的純度不高,提出以下流程:

苯胺在酸性條件下生成鹽酸苯胺被水萃取,在堿性溶液中又被放有機溶劑反萃取,這種萃取——反萃取法簡稱反萃。實驗中反萃的作用是__________;在分液漏斗中進行萃取分液時,應注意不時放氣,其目的是____________________。
(6)苯胺還原性強,易被氧化,請配平下列化學方程式的化學計量數。

查看答案和解析>>
科目:高中化學 來源:2016屆湖北省黃岡市高三4月考試理綜化學試卷(解析版) 題型:選擇題
化學與生活息息相關,下列說法不正確的是( )
A.建筑要使用大量的沙,常使用內陸河的河沙及海洋的海沙
B.含次氯酸鹽的漂白粉與含鹽酸的潔廁靈混合使用會產生有毒氣體
C.漂白粉和明礬都常用于自來水的處理,二者的作用和原理不相同
D.綠色化學的核心是從源頭上減少和消除化工生產對環境的污染
查看答案和解析>>
科目:高中化學 來源:2016屆福建師大附中高三下學期模擬考試理綜化學試卷(解析版) 題型:簡答題
高錳酸鉀是中學化學常用的強氧化劑,實驗室中可通過以下反應制得:
MnO2熔融氧化:3MnO2+KClO3+6KOH 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
K2MnO4歧化:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
相關物質的溶解度數據見下表:
20℃ | K2CO3 | KHCO3 | K2SO4 | KMnO4 |
s(g/100g水) | 111 | 33.7 | 11.1 | 6.34 |
已知K2MnO4溶液顯綠色,KMnO4溶液顯紫紅色。實驗流程如下:

請回答:
(1)步驟①應在 中熔化,并用鐵棒用力攪拌,以防結塊。
A.燒杯 B.蒸發皿 C.瓷坩堝 D.鐵坩堝
(2)①綜合相關物質的化學性質及溶解度,步驟③中可以替代CO2的試劑是 。
A.二氧化硫 B.稀醋酸 C.稀鹽酸 D.稀硫酸
②當溶液pH值達10~11時,停止通CO2;若CO2過多,造成的后果是 。
(3)烘干時,溫度控制在80℃為宜,理由是 。
(4)工業上采用電解K2MnO4水溶液的方法來生產KMnO4,其中隋性電極作陽極,鐵作陰極。請寫出陽極的電極反應式 ,與原方法相比,電解法的優勢為 。
(5)通過用草酸滴定KMnO4溶液的方法可測定KMnO4粗品的純度(質量分數)。
①量取KMnO4溶液應選用 (填“酸式”或“堿式”)滴定管;若量取KMnO4溶液的滴定管用蒸餾水洗凈后未潤洗,則最終測定結果將 (填“偏大”、“偏小”或“不變”)。
②滴定過程中反應的離子方程式為______。(已知:常溫下0.01 mol/L的H2C2O4溶液的pH為2.1)。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年河北省高一平行班下期中化學試卷(解析版) 題型:選擇題
有8種物質:①甲烷;②苯;③聚乙烯;④苯乙烯;⑤環己烷;⑥環己烯;⑦乙醇,既能使酸性高錳酸鉀溶液褪色又能與溴水反應使之褪色的有( )
A.4種 B.3種 C.2種 D.1種
查看答案和解析>>
科目:高中化學 來源:2015-2016學年河北省高二下期中化學試卷(解析版) 題型:選擇題
已知某反應aA(g)+bB(g) cC(g)△H=Q 在密閉容器中進行,在不同溫度(T1和T2 )及壓強(P1 和P2 )下,混合氣體中B的質量分數w(B)與反應時間(t)的關系如圖所示,下列判斷正確的是( )
cC(g)△H=Q 在密閉容器中進行,在不同溫度(T1和T2 )及壓強(P1 和P2 )下,混合氣體中B的質量分數w(B)與反應時間(t)的關系如圖所示,下列判斷正確的是( )
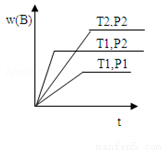
A.T1<T2,P1<P2,a+b>c,Q<0 B.T1>T2,P1<P2,a+b<c,Q>0
C.T1<T2,P1>P2,a+b<c,Q>0 D.T1<T2,P1>P2,a+b>c,Q<0
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com